
【题目】二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如图:
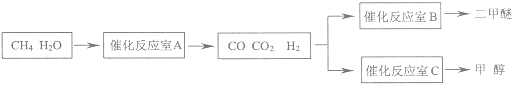
(1)催化反应室B中CO与H2合成二甲醚的化学方程式为___。
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g)![]() CO(g)+3H2(g)……(Ⅰ)
CO(g)+3H2(g)……(Ⅰ)
CO(g)+H2O(g)![]() CO2(g)+H2(g)……(Ⅱ)
CO2(g)+H2(g)……(Ⅱ)
催化反应室C中发生的反应为:
CO(g)+2H2(g)![]() CH3OH(g)……(Ⅲ)
CH3OH(g)……(Ⅲ)
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)……(Ⅳ)
CH3OH(g)+H2O(g)……(Ⅳ)
①已知:原子利用率=![]() ×100%。试求反应(Ⅳ)的原子利用率为___。
×100%。试求反应(Ⅳ)的原子利用率为___。
②反应(Ⅳ)的△S___0(填“>”、“=”或“<”)。
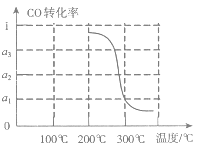
③在压强为5MPa,体积为V L的反应室c中,a mol CO与2a mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的转化率与温度的关系如图。则该反应的△H___0(填“>”、“=”或“<”)。300℃时该反应的平衡常数K=___(用含字母的代数式表示)。
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”。该燃料电池负极的电极反应式为:CH3OCH3-12e-+16OH-=2CO32-+11H2O。有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入 NaHSO3溶液中得SO2气体回收。
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下V L的废气,计算消耗二甲醚的质量___。(写出计算过程)
【答案】2CO+4H2=CH3OCH3+H2O 64% < < ![]()
![]() g
g
【解析】
(1)催化反应室B中CO与H2合成二甲醚,由元素守恒可知有水生成,反应方程式为:2CO+4H2=CH3OCH3+H2O;
(2)①由原子利用率定义可知,反应(Ⅳ)的原子利用率=![]() ×100%=
×100%=![]() ×100%=
×100%=![]() ×100%=64%;
×100%=64%;
②反应(Ⅳ)是气体物质的量减小的反应,混乱度减小,故△S<0;
③由图开始,随温度升高,CO的转化率减小,说明升高温度平衡逆向移动,正反应为放热反应,则△H<0;
300℃平衡时CO转化率为α1,则:
CO(g)+2 H2(g)CH3OH(g)
起始量(mol):a 2a 0
变化量(mol):aα1 2aα1 aα1
平衡量(mol):a(1-α1) 2a(1-α1) aα1
平衡常数K=![]() =
=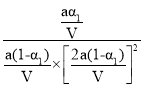 =
=![]() ;
;
(3)含二氧化硫的废气为VL,二氧化硫体积分数为x,则含有二氧化硫体积为Vx L;电解饱和食盐水时阴极电极式为:4H2O+4e-=4OH-+2H2↑,将含SO2的废气通入电解饱和食盐水所得溶液中发生的反应为SO2+ OH-= HSO3-,由整个过程、结合电子转移守恒可得关系式CH3OCH3~12e-~12OH-~12SO2,设消耗二甲醚的质量为m,则:
CH3OCH3~12SO2
46g 12×22.4L
m Vx L
所以m=![]() =
=![]() g。
g。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A.当它们的体积和温度、压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B.当它们的温度和密度都相同时,三种气体的压强:P(H2)>P(N2)>P(O2)
C.当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D.当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由二氧化硅制高纯硅的流程如下,下列判断中错误的是

A. ①②③均属于氧化还原反应 B. H2和HCl均可循环利用
C. SiO2是一种坚硬难熔的固体 D. SiHCl3摩尔质量为135.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据图回答下列问题:

(1)若烧杯中溶液为稀硫酸,则观察到的现象是_______________,电流表指针____(填“偏转”或“不偏转”),两极反应式为:正极_______________;负极______________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应方程式为______。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如下图所示:A、B两个电极均由多孔的碳块组成。该电池的正极反应式为:___________________________。
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如图所示,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体。
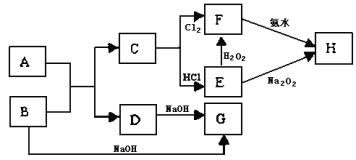
请回答下列问题:
(1)红褐色胶体中H粒子的直径大小范围____;
(2)写出H2O2的电子式:____;
(3)写出B→G的离子方程式____;
(4)若A、B恰好完全反应,将产物C与足量盐酸反应得到amol气体,另取等质量B与足量盐酸反应得到b mol气体,a:b=5:7,则A的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素对肿瘤细胞的杀伤有独特作用,其结构如图所示,下列有关叙述正确的是( )
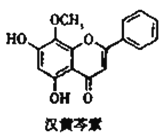
A. 汉黄芩素的分子式为C16H14O5
B. 1mol该物质与NaOH溶液反应,可消耗2molNaOH
C. 1mol该物质与溴水反应,最多消耗1molBr2
D. 该物质可发生取代、加成、缩聚、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅孔雀石[主要成分为CuCO3·Cu(OH)2、CuSiO3·2H2O,含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:

已知: SOCl2+H2O![]() SO2↑+2HCl↑,下列说法不正确的是
SO2↑+2HCl↑,下列说法不正确的是
A. “酸浸” 时应该用盐酸溶解硅孔雀石粉
B. “氧化”时发生反应的离子方程式为:Cl2+2Fe2+![]() 2Fe3++2Cl-
2Fe3++2Cl-
C. “调pH”时,pH需控制在碱性区域,保证铁元素全部以Fe(OH)3形式除去
D. “加热脱水”时,加入SOCl2的目的是生成的HCl抑制CuCl2的水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:
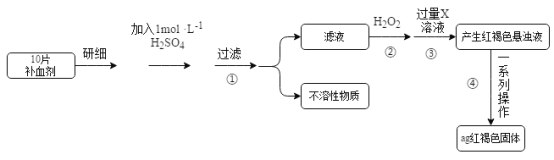
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是取样,先滴加KSCN溶液,再滴加_____,该过程的现象为________。
(2)步骤②加入过量H2O2的目的是________。
(3)步骤③中反应的离子方程式是_________。
(4)步骤④中一系列处理的操作步骤:过滤、_____、灼烧、冷却、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,4.48LCl2通入水中,转移电子数为0.2NA
B.273K、101kPa下,28g乙烯与丙烯混合物中含有C—H键的数目为4NA
C.1L 0.1mol/L Na2SO4溶液中含有的氧原子数为0.4NA
D.1molL-1CH3COOH与1molL-1CH3COONa溶液等体积混合,溶液中CH3COOH和CH3COO-的总数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com