
| A. | 等质量的硫蒸气和硫黄固体分别完全燃烧,前者放出的热量多 | |
| B. | a℃、b kPa下,将0.5 mol O2和1.5 mol H2置于密闭容器中充分反应生成H2O(g),放热c kJ,其热化学方程式为2H2(g)+O2(g)=2H2O(g)△H=-2c kJ•mol-1 | |
| C. | 由N2O 4(g)?2NO2(g)△H=-56.9 kJ•mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ | |
| D. | 稀硫酸溶液与稀NaOH溶液反应的中和热为57.3 kJ•mol-1,则稀醋酸溶液与稀NaOH溶液反应的热化学方程式可表示为CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3 kJ•mol-1 |
分析 A.硫蒸气变化为硫固体为放热过程;
B.反应焓变是指反应物完全反应放出的热量,和反应物质的聚集状态、物质的量、温度、压强有关;
C.可逆反应中反应物不能全部转化为生成物;
D.醋酸是弱酸存在电离平衡,电离过程是吸热过程.
解答 解:A.硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,故A正确;
B.a℃、b kPa下,将0.5mol O2和1.5mol H2置于密闭容器中充分反应生成H2O(g),放热c kJ,氧气全部反应,氢气过量,所以1mol氧气全部反应放热2cKJ,其热化学方程式为2H2(g)+O2(g)$\frac{\underline{\;\;\;a℃\;\;\;}}{bkPa}$2H2O(g)△H=-2c kJ•mol-1 ,故B错误;
C.N2O 4(g)?2NO2(g)该反应为可逆反应,可逆反应中反应物不能全部转化为生成物,则1mol N2O4(g)置于密闭容器中充分反应,参加反应的N2O4(g)小于1mol,所以放热小于56.9kJ,故C错误;
D.醋酸是弱酸存在电离平衡,电离过程是吸热过程,稀醋酸溶液与稀NaOH溶液反应的热化学方程式可表示为CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H>-57.3kJ•mol-1,故D错误;
故选A.
点评 本题考查了燃烧热、中和热概念分析、热化学方程式书写方法,题目难度中等,明确反应热、中和热、燃烧热的概念以及热化学方程式的书写方法是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 镀锡的铁皮,破损后铁皮反而易被腐蚀 | |
| B. | 纯铁比生铁更易被腐蚀 | |
| C. | 金属的电化腐蚀比化学腐蚀普遍 | |
| D. | 金属腐蚀的本质是M-ne-=Mn+而被损耗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
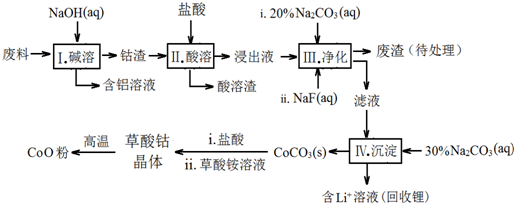
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
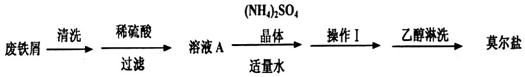
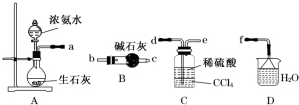
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若A2和B2的总能量之和大于生成的AB的总能量,则反应吸热 | |
| B. | 若A2和B2的总能量之和小于生成的AB的总能量,则反应放热 | |
| C. | 若该反应为放热反应,则Q1+Q2<2Q3 | |
| D. | 若该反应为吸热反应,则Q1+Q2<Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于40.00ml | B. | 40.00ml | C. | 大于10.00ml | D. | 10.00ml |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com