如图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
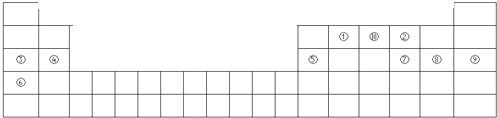
(1)在这10种元素中,原子半径(⑨除外)最大的是
(填元素名称),化学性质最不活泼的元素是
(填“元素符号”).
(2)元素①的原子结构示意图为
;元素①的最高价氧化物结构式为:
,元素⑩的单质电子式为:
.请用电子式表示元素④和⑧形成的化合物的形成过程:
.
(3)分别写出元素⑤的最高价氧化物的水化物与⑥和⑧的最高价氧化物的水化物反应的离子方程式:
(4)利用元素⑤的单质与硫酸铜溶液反应原理设计成原电池,试在右面的方框内画出原电池装置图,

标出原电池的电极材料和电解质溶液,并写出负极的电极反应为
.
(5)一定质量的元素③和⑤的单质以
比例(质量之比)混合置于水中产生的H
2最多.
(6)已知下列元素的原子半径,根据表中数据推测磷原子的半径可能是
A、0.80×10
-10m
B、1.10×10
-10m
C、1.20×10
-10m
D、0.70×10
-10m
(7)元素⑦在元素周期表中的位置是
,元素⑦的一种核素的质子数和中子数相等则这种核素的符号是
;元素⑧在自然界中有质量数为35和37的两种核素,元素⑧的相对原子质量为35.5,则两核素在自然界中的含量之比约为
.
| 原子 | N | S | O | Si |
| 半径r/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |



 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
 标出原电池的电极材料和电解质溶液,并写出负极的电极反应为
标出原电池的电极材料和电解质溶液,并写出负极的电极反应为