
在一定密闭容器中,反应aA(g)═bB(g)达平衡后,保持温度及各物质的量不变,将容器体积增加1倍,当达到新平衡时,B的浓度是原来的60%,则下列说法不正确的是( )
|
| A. | 平衡向正反应方向移动了 |
|
| B. | 物质A的转化率减少了 |
|
| C. | 容器体积增加可以是向其中充入了惰性气体 |
|
| D. | a<b |
| 化学平衡的影响因素.. | |
| 专题: | 化学平衡专题. |
| 分析: | 先假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的60%,比假设大,说明平衡向生成B的方向移动,则a<b,据此结合选项判断. |
| 解答: | 解:先假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的60%,比假设大,说明平衡向生成B的方向移动,则a<b, A、假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的60%,大于原来的50%,说明平衡向生成B的方向移动,即向正反应移动,故A正确; B、平衡向正反应移动,A的转化率增大,故B错误; C、向其中充入了惰性气体,容器体积增加,故C正确; D、减小压强,平衡向生成B的方向移动,则a<b,故D正确; 故选B. |
| 点评: | 本题考查化学平衡移动等,难度不大,注意利用假设法分析、判断平衡移动方向. |


科目:高中化学 来源: 题型:
(1)(3分)有机化合物的制备、提纯和检验是有机化学研究的基础。
①实验室用乙醇和浓硫酸反应制备乙烯,应将反应温度控制在 ▲ (填字母。下同)左右。
a. 140℃ b. 170℃ c. 100℃
②蛋白质提纯可用盐析法,下列盐溶液能用于蛋白质提纯的有 ▲ 。
a. Na2SO4 b. AgNO3 c. CuCl2
③鉴别乙酸和甲酸甲酯,可采用的方法是 ▲ 。
a.取样,滴加银氨溶液,水浴加热,观察是否有银镜生成
b.取样,加入乙醇,观察液体是否分层
c.取样,测定试样的核磁共振氢谱,观察谱图中吸收峰的个数
(2)(5分)某地近日自来水产生异味,原因是水源被苯酚污染。含苯酚的工业废水必须处理达标后才能排放,苯酚含量在1 g·L-1 以上的工业废水应回收苯酚。某研究性学习小组设计下列流程,探究废水中苯酚的回收方法。


①可用 ▲ 为试剂检验水样中是否含有苯酚。
②操作I的名称为 ▲ ,试剂a的化学式为 ▲ 。
③通入CO2发生反应生成苯酚的化学方程式为 ▲ 。
(3)(7分)某有机物的分子式为C3H6O3。
①1mol该有机物充分燃烧生成CO2和H2O,消耗O2在标准状况下的体积为 ▲ L。
②官能团决定有机物的化学性质。取等量的该有机物两份,分别与足量的碳酸氢钠和金属钠反应,生成的气体在同温同压下体积相等。该有机物含有的官能团为 ▲ 、 ▲ (填名称),请写出该物质的一种结构简式 ▲ 。
③若该有机物两分子间相互反应能生成含有六元环状结构的产物,写出该产物的结构简式 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作和说法正确的是( )
|
| A. | 用pH试纸检验气体的酸碱性时,一定要先用蒸馏水润湿 |
|
| B. | 润洗滴定管:从滴定管上口加入所要盛装的酸或碱溶液至“0”刻线,再将液体从滴定管下部放出,重复操作2~3次 |
|
| C. | 用瓷坩埚加热熔化碳酸钠固体 |
|
| D. | Mg和Al分别为电极,插入NaOH溶液中,构成原电池,探究Mg、Al的活泼性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于如图所示装置的下列叙述,正确的是( )
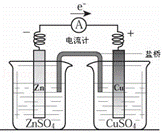
|
| A. | 电流方向是从锌片经导线流向铜片 |
|
| B. | 锌是阳极,锌片上有大量气泡产生 |
|
| C. | 铜离子在铜片表面被氧化,质量逐渐增大 |
|
| D. | 盐桥作用主要是离子通道和保持溶液电中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
镁电池毒性低、污染小,电压高而平稳,它逐渐成为人们研制绿色电池的关注焦点.其中一种镁电池的反应原理为:xMg+Mo3S4 Mg2Mo3S4,下列说法不正确的是( )
Mg2Mo3S4,下列说法不正确的是( )
|
| A. | 放电时,Mo3S4发生氧化反应 |
|
| B. | 放电时,正极反应式:Mo3S4+2xe﹣→Mo3S42x﹣ |
|
| C. | 充电时,Mg2+向阴极迁移 |
|
| D. | 充电时,阴极反应式:xMg2++2xe﹣→xMg |
查看答案和解析>>
科目:高中化学 来源: 题型:
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl﹣的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.
(1)写出该反应的离子方程式 .
(2)反应开始时反应速率加快的原因是 .
(3)反应后期反应速率减慢的原因是 .

查看答案和解析>>
科目:高中化学 来源: 题型:
根据有机物的命名原则,下列命名正确的是( )
|
| A. |
|
|
| B. | CH3CH(C2H5)CH2CH2CH3 2﹣乙基戊烷 |
|
| C. | CH3CH(NH2)CH2COOH α﹣氨基丁酸 |
|
| D. | 3,3﹣二甲基﹣2﹣丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:将一定量Cl2通入KOH溶液,可能生成KCl、KClO、KClO3,且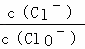 的值与温度高低有关.当n(KOH)=6a mol时,下列有关说法错误的是( )
的值与温度高低有关.当n(KOH)=6a mol时,下列有关说法错误的是( )
|
| A. | 若某温度下,反应后 |
|
| B. | 参加反应的氯气的物质的量等于3a mol |
|
| C. | 改变温度,反应中转移电子的物质的量ne的范围:3a mol<ne<5a mol |
|
| D. | 改变温度,产物中KClO3的最大理论产量为a mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+3B(g)===2C(g)+2D(g),在不同情况下测得的反应速率如下,其中反应速率最大的是( )
A.v(D)=0.4 mol·L-1·s-1 B.v(C)=0.5 mol·L-1·s-1
C.v(B)=0.6 mol·L-1·s-1 D.v(A)=0.15 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com