
下列各种情况下一定能大量共存的离子组为( )
A.pH=7的溶液中:Fe3+、Cl-、Na+、NO
B.水电离出的[H+]=1×10-3 mol·L-1的水溶液中:Na+、CO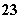 、Cl-、K+
、Cl-、K+
C.pH=1的水溶液中:NH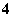 、Cl-、Mg2+、SO
、Cl-、Mg2+、SO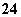
D.Al3+、HCO 、I-、Ca2+
、I-、Ca2+
科目:高中化学 来源: 题型:
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4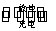
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移
0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题:

(1)A是铅蓄电池的 极,铅蓄电池正极反应式为 ,放电过程中电解液的密度 (填“减小”“增大”或“不变”)。
(2)Ag电极的电极反应式是 ,该电极的电极产物共 g。
(3)Cu电极的电极反应式是 ,CuSO4溶液的浓度 (填“减小”“增大”或“不变”)。
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示 。
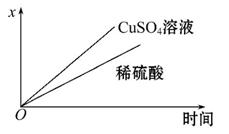
a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
查看答案和解析>>
科目:高中化学 来源: 题型:
按图甲装置进行实验,若图乙中横坐标x表示通过电极的电子的物质的量。下列叙述正确的是( )
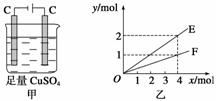
A.F表示反应生成Cu的物质的量
B.E表示反应实际消耗H2O的物质的量
C.E表示反应生成O2的物质的量
D.F表示反应生成H2SO4的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列浓度关系正确的是( )
A.氯水中:[Cl2]=2{[ClO-]+[Cl-]+[HClO]}
B. 氯水中:[Cl-]>[H+]>[OH-]>[ClO-]
C.等体积等浓度的氢氧化钠与醋酸混合:[Na+]=[CH3COO-]
D.Na2CO3溶液中:[Na+]>[CO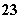 ]>[OH-]>[HCO
]>[OH-]>[HCO ]>[H+]
]>[H+]
查看答案和解析>>
科目:高中化学 来源: 题型:
0.02 mol·L-1的HCN溶液与0.02 mol·L-1 NaCN溶液等体积混合,已知混合溶液中[CN-]<[Na+],则下列关系中,正确的是( )
A.[Na+]>[CN-]>[H+]>[OH-]
B.[HCN]+[CN-]=0.04 mol·L-1
C.[Na+]+[H+]=[CN-]+[OH-]
D.[CN-]>[HCN]
查看答案和解析>>
科目:高中化学 来源: 题型:
研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是(双选)( )。
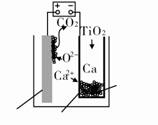
A.由TiO2制得1 mol金属Ti,理论上外电路通过2 mol电子
B.阳极的电极反应式为C+2O2--4e-===CO2↑
C.在制备金属钛前后,整套装置中CaO的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接PbO2电极
查看答案和解析>>
科目:高中化学 来源: 题型:
cNH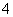 )相同的下列溶液①NH4Cl ②NH4)2SO4 ③NH4HSO4 ④NH4HCO3。其物质的量浓度由大到小的顺序是 )。
)相同的下列溶液①NH4Cl ②NH4)2SO4 ③NH4HSO4 ④NH4HCO3。其物质的量浓度由大到小的顺序是 )。
A.②③①④ B.④①③②
C.①④③② D.②④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
已知N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1,下列结论正确的是( )
A.在密闭容器中加入1 mol N2和3 mol H2充分反应放热92.4 kJ
B.N2(g)+3H2(g)2NH3(l) ΔH=-Q kJ·mol-1,则Q>92.4
C.增大压强,平衡向右移动,平衡常数增大
D.若一定条件下反应达到平衡,N2的转化率为20%,则H2的转化率一定为60%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com