
| A. | HOCH2CH2OH | B. | HOCH2CH(OH)CH3 | C. | CH3CH2CH2OH | D. | CH3CH(OH)CH(OH)CH3 |
分析 有机物甲能发生银镜反应,含有-CHO,为醛或甲酸形成的酯,甲催化加氢还原成有机物乙,则乙中含有羟基,1mol乙跟足量的金属钠反应放出标准状况下H222.4L,氢气的物质的量为1mol,说明乙中含有2个羟基或1个羟基、1个羧基,结合选项判断乙的可能结构,据此解答.
解答 解:A.甲为OHCCHO或HOCH2CHO,能发生银镜反应,能与氢气发生加成反应,生成乙为HOCH2CH2OH,1molHOCH2CH2OH与钠反应生成1mol氢气,故A正确;
B.若乙为HOCH2CH(OH)CH3,1mol乙与钠反应生成1mol氢气,甲与氢气发生加成反应生成乙,则甲可以为OHCCH(OH)CH3能发生银镜反应,故B正确;
C.若乙为CH3CH2OH,1mol乙与钠反应生成0.5mol氢气,故C错误;
D.若乙为CH3CH(OH)CH(OH)CH3,1mol乙与钠反应生成1mol氢气,甲与氢气发生加成反应生成乙,则甲不可能含有-CHO,甲不能发生银镜反应,故D错误.
故选CD.
点评 本题考查有机物的推断,为高频考点,侧重于学生的分析能力的考查,难度中等,掌握官能团的性质与转化是关键,注意利用验证法进行解答.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
| A. | N2 | B. | NO | C. | NO2 | D. | NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| B. | 沸点:CH4>SiH4>GeH4>SnH4 | |
| C. | 熔点由高到低:Al>Mg>Na | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备乙酸乙酯,回答有关问题:
实验室制备乙酸乙酯,回答有关问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | J | |||||||
| 2 | E | K | F | |||||
| 3 | A | C | D | I | G | R | ||
| 4 | B | H |
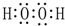 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe2(SO4)3溶液中加入过量的Na2S:2Fe3++S2-=2Fe2++S↓ | |
| B. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 用铜作电极电解饱和食盐水:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 将铜屑加入Fe3+ 溶液中:2Fe3++Cu=2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
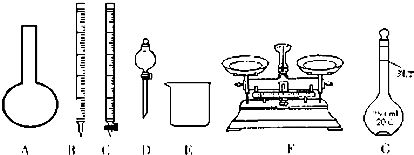
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
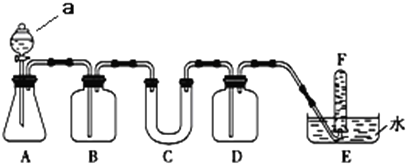
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | Na2O2 | 与CO2及水蒸气反应,产生O2 |
| D | . |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com