
| A. | 氯气是一种有毒气体,不能用于自来水的杀菌消毒 | |
| B. | 高纯度的二氧化硅晶体广泛用作制造光导纤维 | |
| C. | 氧化铝可用于冶炼金属铝的原料,也是一种比较好的耐火材料 | |
| D. | 过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源 |
分析 A、氯气与水反应生成HClO,可杀菌消毒;
B、光导纤维的主要成分是二氧化硅;
C、电解氧化铝得到金属铝,氧化铝熔点高;
D、过氧化钠和人呼出的二氧化碳和水蒸气反应生成氧气;
解答 解:A.氯气与水反应生成HClO,具有强氧化性,则氯气用于自来水杀菌消毒,故A错误;
B、二氧化硅折射率很大,光在里面传播发生全反射,所以用于光导纤维,故B正确;
C、电解氧化铝得到金属铝,氧化铝熔点高,氧化铝是冶炼金属铝的原料,也是一种比较好的耐火材料,故C正确;
D、过氧化钠和人呼出的二氧化碳和水蒸气反应生成氧气,过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源,故D正确;
故选A.
点评 本题考查了物质性质的分析和应用,主要是氯气、过氧化钠、氧化铝、二氧化硅物质的应用和用途掌握,题目较简单.


科目:高中化学 来源: 题型:选择题
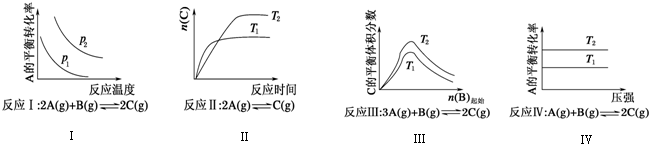
| A. | 反应Ⅰ:△H>0,p2>p1 | B. | 反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1 | ||
| C. | 反应Ⅱ:△H>0,T1>T2 | D. | 反应Ⅳ:△H<0,T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
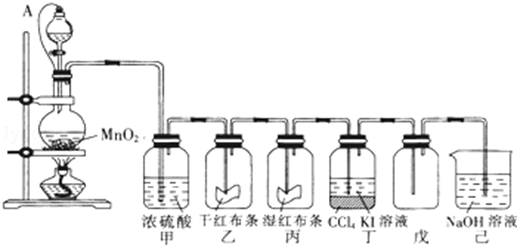
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
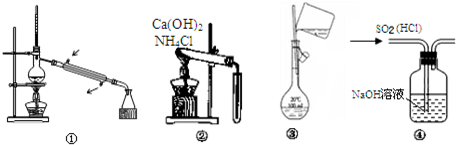
| A. | 图①常用于分离沸点不同且彼此互溶的液态混合物 | |
| B. | 图②可用于实验室制备并收集少量的NH3 | |
| C. | 图③表示的是实验室配制溶液转移过程 | |
| D. | 图④可用于除去SO2中的HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5?mol•L-1 | B. | 2.5?mol•L-1 | C. | ?d/400 mol•L-1 | D. | ?d/200mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com