
【题目】下图中A、B、C分别是三种有机物的结构模型:
A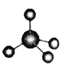 B
B C
C
请回答下列问题:
(1)上述三种模型最能真实体现有机物空间构型的是_____(填序号)。
(2)B及其同系物的分子式符合通式____(用n表示)。当n=_____时,烯烃开始出现同分异构体。
(3)有机物C中,共直线的的原子有_______个。
(4)有机物C具有的结构或性质是______(填字母序号)。
a .是碳碳双键和碳碳单键交替的结构 b. 有毒、不溶于水、密度比水小
c. 不能使酸性KMnO4溶液和溴水褪色 d. 一定条件下能与氢气或氧气反应
(5)等物质的量的A、B、C三种有机物完全燃烧生成H2O和CO2,消耗氧气的体积(相同状况下)最大的是_____(填分子式)。
【答案】A CnH2n(n≥2) 3 4 bd C6H6
【解析】
从模型看,A、B、C分别为甲烷、乙烯、苯。
(1)三种模型最能真实体现有机物空间构型的是甲烷的球棍模型,它不仅能反映甲烷的原子分布、空间结构,还能体现原子间的共价键,B只能体现乙烯的的原子分布、空间结构,但不能体现原子间的共价键;C只能体现苯的原子分布、空间结构,但不能反映原子间的共价键的真实情况。
(2)B为乙烯,它的同系物属于烯烃,分子式符合通式CnH2n(n≥2)。乙烯没有同分异构体,丙烯没有烯烃类的同分异构体,但有环烷烃类的同分异构体。
(3)有机物C为苯,从结构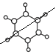 可看出共直线的原子数。
可看出共直线的原子数。
(4)有机物C具有的结构或性质:
a .苯分子中六个碳碳键完全反应,而不是碳碳双键和碳碳单键交替的结构;
b. 苯有毒、不溶于水、密度比水小;
c. 苯不能使酸性KMnO4溶液褪色,但能萃取溴水中的溴而使溴水褪色;
d. 苯在一定条件下能与氢气发生加成反应,能在氧气中燃烧;
由此可判断四个选项是否正确。
(5)1molA、B、C三种有机物完全燃烧生成H2O和CO2,消耗氧气的物质的量分别为2mol、3mol、7.5mol,通过比较可确定耗氧最大的物质。
从模型看,A、B、C分别为甲烷、乙烯、苯。
(1)从原子分布、空间结构、原子间的共价键三个方面判断,三种模型最能真实体现有机物空间构型的是甲烷的球棍模型;答案为:A;
(2)B为乙烯,它的同系物属于烯烃,分子式符合通式CnH2n(n≥2)。乙烯没有同分异构体,丙烯没有烯烃类的同分异构体,但有环烷烃类的同分异构体;答案为:CnH2n(n≥2);3;
(3)有机物C为苯,从结构 可看出共直线的原子数为4个;答案为:4;
可看出共直线的原子数为4个;答案为:4;
(4)a .苯分子中六个碳碳键完全反应,而不是碳碳双键和碳碳单键交替的结构,a错误;
b. 苯有毒、不溶于水、密度比水小,b正确;
c. 苯不能使酸性KMnO4溶液褪色,但能萃取溴水中的溴而使溴水褪色,c错误;
d. 苯在一定条件下能与氢气发生加成反应,能在氧气中燃烧,d正确;
由此可判断四个选项中bd正确;答案为:bd;
(5)1molA、B、C三种有机物完全燃烧生成H2O和CO2,消耗氧气的物质的量分别为2mol、3mol、7.5mol,通过比较可确定耗氧最大的物质苯。答案为:C6H6。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】下列叙述错误的是![]()
A.短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素
B.铍的最高价氧化物的水化物可能具有两性
C.已知锶![]() 是第 IIA元素,碳酸锶难溶于水,但易溶于盐酸
是第 IIA元素,碳酸锶难溶于水,但易溶于盐酸
D.科学家在周期表中金属元素与非金属元素分界线处找到了优良的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D四种物质之间的转化关系如图所示![]() 部分产物已略去
部分产物已略去![]() ,下列说法正确的是
,下列说法正确的是![]()

A.若A为![]() 溶液,B可能为氨水,反应
溶液,B可能为氨水,反应![]() 的离子方程式为:
的离子方程式为:![]()
B.若A为Fe,B可能为稀硝酸,反应![]() 的离子方程式为:
的离子方程式为: ![]()
C.若A为NaOH溶液,B可能为![]() ,可用
,可用![]() 溶液鉴别C、D溶液
溶液鉴别C、D溶液
D.若A为![]() ,B可能为
,B可能为![]() ,实验室可用加热固体C的方法制取
,实验室可用加热固体C的方法制取![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸是三元弱酸,常温下三级电离常数分别是:Ka1=7.1×10-3,Ka2=6.2×10-8,Ka3=4.5×10-13,解答下列问题:
(1)常温下同浓度①Na3PO4、②Na2HPO4、③NaH2PO4的pH由小到大的顺序___(填序号)。
(2)常温下,NaH2PO4的水溶液pH___(填“>”“<”或“=”)7。
(3)常温下,Na2HPO4的水溶液呈___(填“酸”“碱”或“中”)性,用Ka与Kh的相对大小,说明判断理由:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛。
Ⅰ.已知硼镁矿的主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O。一种利用硼镁矿制取金属镁及粗硼的工艺流程如图所示:

(1)硼砂中B元素的化合价为________,将硼砂溶于热水后,用硫酸调节溶液的pH为2~3以制取H3BO3,该反应的离子方程式为______________________;X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为___________________。
(2)由MgCl2·6H2O制备MgCl2时,需要在HCl氛围中加热,其目的是__________。
(3)Mg—H2O2酸性燃料电池的反应原理为Mg+H2O2+2H+===Mg2++2H2O。常温下,若起始电解质溶液pH=1,则pH=2时,溶液中所含Mg2+的物质的量浓度为__________;已知常温下,Ksp[Mg(OH)2]=5.6×10-12,当电解质溶液的pH=6时,_____(填“有”或“无”)Mg(OH)2沉淀析出 (忽略反应过程中溶液的体积变化)。
Ⅱ.工业上可用纳米MgH2和LiBH4组成的体系储放氢,如图所示。

(4)写出放氢过程中发生反应的化学方程式____________________。
Ⅲ.MgO浆液是一种高活性的脱硫剂,常用于脱除烟气中的SO2,发生的主要反应如下:

Mg(OH)2+SO2===MgSO3+H2O
MgSO3+SO2+H2O===Mg(HSO3)2
Mg(HSO3)2+Mg(OH)2===2MgSO3+2H2O
2MgSO3+O2===2MgSO4
已知25 ℃时,Ksp(MgSO3)=3.86×10-3,Ksp(CaSO3)=3.1×10-7。
(5)其他条件相同时,镁基和钙基的脱硫效率与液、气摩尔流量比的变化情况如图所示。镁基的脱硫效率总是比钙基的大,除生成的MgSO4具有良好的水溶性外,还因为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是 ( )

A.溶液B中发生的反应为2SO2+O2=2SO3
B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+
C.由以上流程可推知氧化性:Fe3+>O2>SO42—
D.此工艺的优点之一是物质能循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol·L-1CuCl2溶液中滴入0.1ml·L-1的Na2S溶液,滴加过程中溶液中-1gc(Cu2+)随滴人的Na2S溶液体积的变化如图所示。下列叙述正确的是
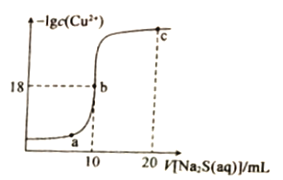
A. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)==2c(Na+)
B. Ksp(CuS)的数量级为10-36
C. a、b、c三点溶液中,b点水的电离程度最大
D. c点溶液中:c(C1-)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯和碘是ⅦA元素,回答下列问题:
(1)I3-中心原子的价层电子对数为_______ ,沸点ICl____Cl2(填大于,小于,等于)。
(2)已知CsICl2受热分解,该分解的化学方程式是___________________。
(3)已知高碘酸的结构如图1所示,1mol高碘酸中含有__________mol![]() 键。
键。
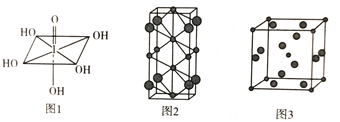
(4)Na和Cl两种元素可以形成不同类型的晶体,如图2和图3(大球为氯原子,小球为钠原子),图2化学式为_____________;图3中Na+的配位数为___________。
(5)若图3晶胞的边长为a cm,则晶体的密度![]() =____(NA表示阿伏加德罗常数的值)。
=____(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.溴乙烷与少量乙醇的混合物加水除去乙醇的方法,原理类似于溴水中加四氯化碳萃取溴
B.中和滴定实验中,如用于盛放待测溶液的锥形瓶洗净后未干燥,不影响测定结果
C.由![]() 稀
稀![]() 构成的原电池,溶液中加入适量
构成的原电池,溶液中加入适量![]() 能提高电池放电效率
能提高电池放电效率
D.蛋白质与氨基酸遇到双缩脲试剂均会出现紫玫瑰色现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com