
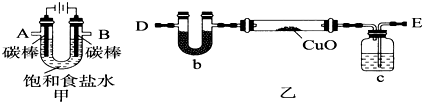
分析 (1)根据质量m=CVM来计算;定容时俯视液面会使溶液体积偏小;
(2)由于A所在的极为阴极,电极反应为:2H2O+2e-=H2↑+2OH-,然后根据实验目的是用电解产生的H2还原CuO粉末,据此分析A所连的导管;电解饱和食盐水时,阳极上Cl-放电,阴极上H+放电,据此分析;
(3)此实验是用氢气来还原CuO,若加热的是氢气和空气的混合物,在易发生爆炸;
(4)实验原理是将氢气通过E进入C中的浓硫酸进行干燥,故通到硬质玻璃管中后,在加热条件下能将CuO还原为Cu,并生成水蒸汽,从而被b中的碱石灰吸收,即硬质玻璃管的减重量即为CuO中的含有的氧原子的质量,b的增重量即为H2O的质量,据此分析.
解答 解:(1)所需的氯化钠的质量m=CVM=4mol/L×0.25L×58.5g/mol=58.5g;定容时俯视液面会使溶液体积偏小,则浓度偏大,故答案为:58.5,大于;
(2)由于A所在的极为阴极,电极反应为:2H2O+2e-=H2↑+2OH-,故从A导出的气体是氢气,由于本实验的目的是用电解产生的H2还原CuO粉末,故要将从A中出来的气体先经浓硫酸干燥,然后通入CuO固体上,故A所连的导管应为E;电解饱和食盐水时,阳极上Cl-放电:2Cl-+2e-=Cl2,阴极上H+放电:2H2O+2e-=H2↑+2OH-,故电解的总反应为:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,故答案为:E,2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
(3)此实验是用氢气来还原CuO,若加热的是氢气和空气的混合物,在易发生爆炸,故在加热前应先检验氢气的纯度,故答案为:检验氢气的纯度;
(4)实验原理是将氢气通过E进入C中的浓硫酸进行干燥,故通到硬质玻璃管中后,在加热条件下能将CuO还原为Cu,并生成水蒸汽,从而被b中的碱石灰吸收,即硬质玻璃管的减重量即为CuO中的含有的氧原子的质量,b的增重量即应为生成H2O的质量.
故当U型管质量的质量不再变化时,说明CuO中的氧元素已经完全被结合生成水,即不再有水生成;但由于空气中的水蒸气和二氧化碳能通过D进入b从而被吸收,故b增重的质量偏大,导致产生误差;若不改变,则会导致生成水的质量偏高,则测得的CuO中氧原子的质量偏多,故Cu原子的质量偏小,则铜的相对原子质量偏低;
由于生成水的质量为dg,故水的物质的量为n=$\frac{d}{18}$mol,故CuO中氧原子的质量为m=$\frac{d}{18}mol×16g/mol$=$\frac{16d}{18}$g,由于CuO的质量为(b-a)g,故CuO中含有的铜原子的质量为:
(b-a)g-$\frac{16d}{18}$g=$\frac{18(b-a)-16d}{18}$g.由于水的物质的量为$\frac{d}{18}mol$,而其中的氧原子来自于CuO,物质的量也为$\frac{d}{18}mol$,而在CuO中,铜原子和氧原子的物质的量之比为1:1,故含有的铜原子的物质的量也为$\frac{d}{18}mol$,则铜原子的摩尔质量为M=$\frac{m}{n}$=$\frac{\frac{18(b-a)-16d}{18}g}{\frac{d}{18}mol}$=$\frac{18(b-a)}{d}-16$g/mol,即铜的相对原子质量为$\frac{18(b-a)}{d}-16$.
故答案为:u型管质量至恒重(或连续两次称量质量之差小于0.1g);空气中的CO2和水蒸气会通过D口进入U形管;从而产生较大的实验误差; 偏低;$\frac{18(b-a)}{d}-16$.
点评 本题考查了物质性质的验证和物质测定实验设计方案,物质性质的掌握,实验步骤和实验原理的理解是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  向1L浓度均为0.1 mol•L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol•L-1的稀H2SO4 | |
| B. | 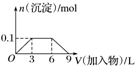 向1L浓度分别为0.1 mol•L-1和0.3 mol•L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol•L-1的稀NaOH溶液 | |
| C. | 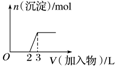 向烧碱溶液中滴加明矾溶液 | |
| D. | 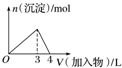 向AlCl3溶液中滴加过量氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
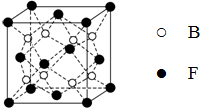 已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.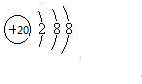 ,X的化学式Na3AlF6.
,X的化学式Na3AlF6.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②⑤ | C. | ③④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com