
不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金。
Ⅰ.氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。
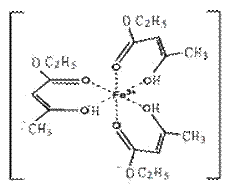
(1)此配合物中,铁离子的价电子排布式为 。
(2)此配合物的-C2H5中C-H间形成化学键的原子轨道分别是 ; 。
Ⅱ.(2)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n ,与Ni(CO)n中配体互为等电子体的离子的化学式为 (写出一个即可)。
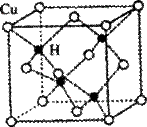
(2)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。已知CuH晶体结构单元如图所示。该化合物的的密度为ρg/cm3,阿伏加德罗常数的值为NA,则该晶胞中Cu原子与H原子之间的最短距离为 cm(用含ρ和NA的式子表示)。
Ⅲ.硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域应用。
(1)三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性的无色有毒腐蚀性气体,其分子的立体构型为 ,B原子的杂化类型为 。
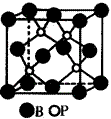
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。下图示意的是磷化硼的晶体结构单元,则磷化硼的化学式为 ,微粒间存在的作用力为 。
(3)正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连(如下图)。
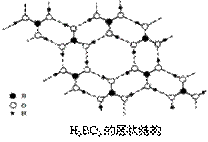
①1 mol H3BO3的晶体中有 mol氢键。
②硼酸溶于水应生成弱电解质一水合硼酸H2O·B(OH)3,它电离生成少量[B(OH)4]- 和的H+ 离子。则硼酸为 元酸,[B(OH)4]-含有的化学键类型为 。
【答案】Ⅰ.(1)3d5;(2)碳原子的sp3杂化轨道;氢原子的1s轨道
Ⅱ.(1)CN-、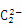 、
、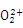
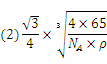
Ⅲ.(1)平面三角形;sp2杂化
(2)BP;共价键
(3)①3;②一;共价键、配位键
【解析】本题考查了晶胞的计算、价电子排布式的书写、等电子体等知识点。
Ⅰ.(1)铁元素是26号元素,其原子核外有26个电子,铁原子失去3个电子变成铁离子,其价电子排布式为:3d5。
(2)乙基上的碳原子都含有4个σ键且不含孤电子对,故都采用sp3杂化,所以C2H5中C-H间碳原子的sp3杂化轨道和氢原子的1s轨道形成化学键,
Ⅱ.(1)CO分子中含有2个原子,其价电子个数是10,所以与Ni(CO)4中配体互为等电子的离子是CN-、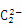 、
、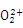 。
。
(2)该晶胞中含有4个H原子,铜原子个数为8×+6×=4,所以该晶胞中含有4个铜原子4个氢原子,设该晶胞的边长为a,则该晶胞中Cu原子与H原子之间的最短距离为: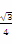 a,a=
a,a=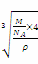 =
=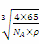 ,该晶胞中Cu原子与H原子之间的最短距离为:
,该晶胞中Cu原子与H原子之间的最短距离为: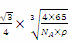 。
。
Ⅲ.(1)BF3中B原子形成3个σ键,孤对电子数为(3-1×3)=0,故BF3的空间构型是平面三角形,中心原子的杂化类型为sp2杂化。
(2)由图可知,一个晶胞中含有B原子的个数为8×+6×=4,含有P原子的个数为4,故磷化硼的化学式为BP,微粒间存在的作用力为共价键。
(3)①一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,因此含有1 molH3BO3分子的晶体中有3mol氢键。
②硼酸中B原子属于缺电子原子,在水溶液中结合水电离出的氢氧根离子,B(OH)3+H2O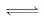
 +H+,破坏了水的电离平衡而使溶液显酸性,所以硼酸为一元酸,[B(OH)4]-含有的化学键类型为共价键、配位键。
+H+,破坏了水的电离平衡而使溶液显酸性,所以硼酸为一元酸,[B(OH)4]-含有的化学键类型为共价键、配位键。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
下列说法正确的是(N0表示阿伏加德罗常数的值)( )
①在常温常压下,11.2L N2含有的分子数为0.5N0
②在常温常压下,1mol Ne含有的原子数为N0
③71g Cl2所含原子数为2N0
④在同温同压时,相同体积的任何气体单质所含的原子数相同.
|
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
表是元素周期表的一部分,回答下列有关问题:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | Ⅷ |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)写出下列元素符号:① ;⑥ .
(2)画出⑤原子的结构示意图: .
③和⑧元素形成的化合物中含 键.(写化学键类型)
(3)在①﹣﹣⑨的元素中,金属性最强的元素是 ,非金属性最强的元素是 ,最不活泼的元素是 .(均用元素符号表示)
(4)⑧的最高价氧化物对应的水化物化学式是
(5)元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),用一化学反应方程式表达这一事实 .
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g) + 2O2(g)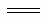 2 NO2(g) ΔH = +67.7kJ/mol
2 NO2(g) ΔH = +67.7kJ/mol
2N2H4(g) + 2NO2(g) 3N2(g)+ 4H2O (g) ΔH = -1135.7kJ/mol
3N2(g)+ 4H2O (g) ΔH = -1135.7kJ/mol
下列说法正确的是
A.N2H4(g) + O2(g) N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O
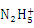 + OH-
+ OH-
C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4-4e- + 4OH- N2 + 4H2O
N2 + 4H2O
D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中物质的分类组合正确的是( )
| A | B | C | D | |
| 强电解质 | Al2(SO4)3 | BaSO4 | HF | KClO3 |
| 弱电解质 | H3PO4 | H2O | CaCO3 | Al(OH)3 |
| 非电解质 | CO2 | NH3•H2O | NH3 | HI |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于CH4和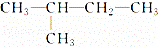 的叙述正确的是( )
的叙述正确的是( )
|
| A. | 通常情况下它们都是气态烷烃 |
|
| B. | 与所有烷烃互为同系物 |
|
| C. | 因为它们结构相似,所以它们的化学性质相似,物理性质相同 |
|
| D. | 均能用CnH2n+2组成通式来表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是( )
|
| A. | HCl和NaOH反应的中和热△H=﹣57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol |
|
| B. | CO(g)的燃烧热是283.0 kJ/mol,则2C02(g)=2CO(g)+02(g)反应的△H=+2×283.0 KJ/mol |
|
| C. | 反应A(s)+B(g)=C(s)+D(s)能自发进行,则一定有△H>0 |
|
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.
Ⅰ.将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果: 与盐酸反应最剧烈, 与盐酸反应的速度最慢.
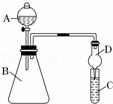
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
(1)检验该装置气密性的操作方法是 ,干燥管D的作用是 .
(2)现有试剂:盐酸、碳酸钙、澄清石灰水、硅酸钠溶液,请从中选择试剂并用如图装置证明酸性:HCl>H2CO3>H2SiO3.则B中应盛装的试剂为 ,C中产生的现象为 有 .请判断 (填“能”或“不能”)根据实验现象判断非金属性:Cl>C>Si.
(3)若C中盛装的是Na2S溶液,A中盛装浓盐酸,B中盛装KMnO4粉末.(KMnO4与浓盐酸常温下快速反应生成氯气)反应开始后观察到C中出现淡黄色浑浊,可证明Cl的非金属性比S (填“强”或者“弱”或者“无法比较”),写出反应的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com