
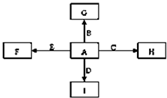
 图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的| 高温 |
| ||
| 高温 |
| ||
| 24 |
| 40 |
| ||
| ||
| ||
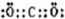 ,为直线型分子,结构式为:O=C=O,故答案为:
,为直线型分子,结构式为:O=C=O,故答案为: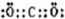 ,O=C=O;
,O=C=O;

科目:高中化学 来源: 题型:
| A、一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
| B、在胶体中加入少量电解质溶液时,可能使胶体发生聚沉 |
| C、溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
| D、溶液中溶质粒子直径小于1nm,而胶体粒子直径在1nm~100nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用1mol/L FeCl3溶液制得氢氧化铁胶体的胶粒数目一定小于1NA |
| B、10L 18.4mol?L-1硫酸与64g铜加热反应,生成SO2分子的数目一定小于1NA |
| C、通常状况下,22.4L氯气与烧碱溶液完全反应,转移电子数目一定小于1NA |
| D、标准状况下,22.4LHF所含分子数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸可保存在带橡皮塞的棕色细口瓶中 |
| B、用pH试纸测定溶液pH时,pH试纸应事先润湿 |
| C、配制一定物质的量浓度的溶液时,选用的容量瓶规格由需配制的溶液体积决定 |
| D、中和滴定时,为了使滴定终点溶液颜色变化明显,可多滴几滴指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
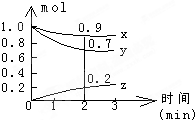 某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
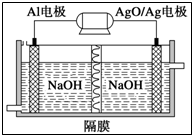 (1)现有以下物质:
(1)现有以下物质:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com