
 A + B + C
A + B + C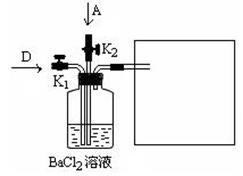
科目:高中化学 来源:不详 题型:计算题
 化工原料,工业上生产硝酸的主要过程如下:
化工原料,工业上生产硝酸的主要过程如下: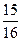 ,则N2的转化率
,则N2的转化率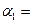 ;若容器压强恒定,达到平衡状态时,N=的转化率为
;若容器压强恒定,达到平衡状态时,N=的转化率为 ,则
,则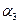
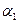 (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。 4NO+6H2O 4NO+3O2+2H2O=4HNO3
4NO+6H2O 4NO+3O2+2H2O=4HNO3 0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程) 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 活性炭,杂质元素有铁、镁、铝、硅、铜等)中提取海棉钯(含Pd>99.9%)的部分工艺流程如下:
活性炭,杂质元素有铁、镁、铝、硅、铜等)中提取海棉钯(含Pd>99.9%)的部分工艺流程如下:
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
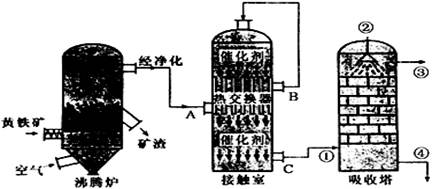
| 压强/MPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
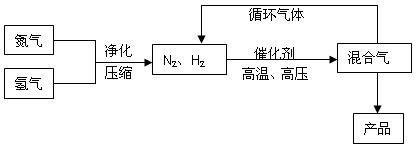
 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。| A.增大压强 | B.降低温度 | C.使用催化剂 | D.增大反应物的浓度 |
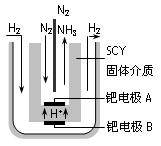
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
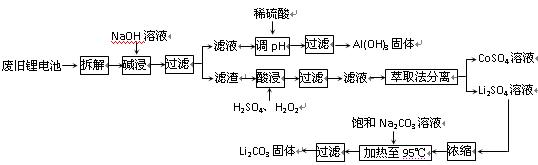
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 I3-。如何用化学方法检验有多碘离子生成 。
I3-。如何用化学方法检验有多碘离子生成 。查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质。 |
| B.工业制硫酸,需要在接触室的两层催化剂之间装上一个热交换器 |
| C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室,避免阳极产生的气体与烧碱反应 |
D.用铂电极电解CuSO4溶液,当Cu2+浓度降低至原来一半时,停止通电,若加入适量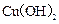 能使溶液恢复成原来浓度 能使溶液恢复成原来浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com