
| A、常温常压下,22.4L甲烷含有的共价键数目为4NA |
| B、1mol Cl2与足量Fe反应,转移电子的数目为3NA |
| C、标准状况下,22.4L二氯甲烷含有的分子数目为NA |
| D、常温下,48g O2和O3混合气体所含氧原子数为3NA |
| 48g |
| 16g/mol |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、焰色反应呈黄色,加硝酸酸化的AgNO3溶液有白色沉淀 |
| B、焰色反应呈紫色,加盐酸酸化的AgNO3溶液有白色沉淀 |
| C、焰色反应呈黄色,加盐酸酸化的AgNO3溶液有白色沉淀 |
| D、焰色反应呈紫色,加硝酸酸化的AgNO3溶液有白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①③ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、炼油厂用蒸馏法生产汽油 |
| B、钢铁厂用热还原法冶炼铁 |
| C、硫酸厂常用接触法生产硫酸 |
| D、氮肥厂用氢气和氮气合成氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
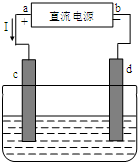 与图有关的下列叙述正确的是( )
与图有关的下列叙述正确的是( )| A、a为直流电源的负极 |
| B、用该装置制白铁(镀锌铁),d为铁电极 |
| C、用该装置精炼铜,d为粗铜电极 |
| D、c、d均为石墨电极电解饱和食盐水时,c电极附近pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小苏打、氢氧化铝可以治疗胃酸过多症 |
| B、淡黄色粉末Na2O2可用于“蛟龙号”的供氧剂 |
| C、造成大气污染的“PM2.5”是气溶胶 |
| D、明矾净水的原理是Al3+水解生成的Al(OH)3胶体有强的吸附性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、①②④⑤ |
| C、②③④⑤ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容量瓶中原有少量蒸馏水 |
| B、溶液从烧杯转移到容量瓶中后洗涤了烧杯 |
| C、定容时观察液面俯视 |
| D、定容时倒转容量瓶几次,发现凹液面最低点低于标线,再补几滴水到标线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com