
| A. | 2.24g | B. | 3.36g | C. | 5.60g | D. | 10.08g |
分析 混合物和稀盐酸反应后过滤,滤液中n(H+)为0.08mol,说明HCl有剩余,则Fe完全反应,残留固体为Cu,n(Cu)=$\frac{1.28g}{64g/mol}$=0.02mol,滤液中无Cu2+,则溶质为FeCl2,根据Cl原子守恒得n(HCl)=2n(FeCl2)+n(HCl)(剩余),所以n(FeCl2)=$\frac{4.40mol/L×0.1L-0.08mol}{2}$=0.18mol,设Fe的物质的量为xmol、Fe2O3的物质的量为ymol,
根据Fe原子守恒得x+2y=0.18
根据转移电子守恒得2x=0.04×2+0.02×2+2y×1,
从而计算n(Fe),根据m=nM计算铁的质量.
解答 解:混合物和稀盐酸反应后过滤,滤液中n(H+)为0.08mol,说明HCl有剩余,则Fe完全反应,残留固体为Cu,n(Cu)=$\frac{1.28g}{64g/mol}$=0.02mol,滤液中无Cu2+,则溶质为FeCl2,根据Cl原子守恒得n(HCl)=2n(FeCl2)+n(HCl)(剩余),所以n(FeCl2)=$\frac{4.40mol/L×0.1L-0.08mol}{2}$=0.18mol,设Fe的物质的量为xmol、Fe2O3的物质的量为ymol,
根据Fe原子守恒得x+2y=0.18
根据转移电子守恒得2x=0.04×2+0.02×2+2y×1,
解得x=0.10、y=0.04,
所以m(Fe)=0.10mol×56g/mol=5.60g,
故选C.
点评 本题考查混合物的计算,侧重考查分析计算能力,明确溶液中的溶质是解本题关键,根据原子守恒、转移电子守恒进行计算,能化繁为简,题目难度中等.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
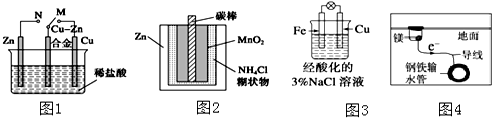
| A. | 图1中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 | |
| B. | 图2中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 | |
| C. | 图3中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现 | |
| D. | 图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发结晶时,当加热至蒸发皿中有大量固体析出时应停止加热,利用余热蒸干剩余溶液 | |
| B. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 | |
| C. | 将过氧化钠固体投入紫色石蕊溶液中,可看到石蕊溶液变蓝 | |
| D. | 用原子吸收光谱可以确定物质中含有哪些金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅和氯化镁熔化 | B. | 碘和氯化铵受热变成气体 | ||
| C. | 碘和干冰的升华 | D. | 氯化钠和氯化氢溶于水 | ||
| E. | 硅和蔗糖的熔化 | F. | 酒精和水的挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应的离子方程式:2H++CO32-═H2O+CO2↑ | |
| B. | 若向Na2CO3溶液中通入足量的SO2气体,也可得到CO2 | |
| C. | HSO3-的水解程度大于其电离程度 | |
| D. | 各级电离常数:K1(H2SO3)>K1(H2CO3)>K2(H2SO3)>K2(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.60g | B. | 3.90g | C. | 6.50g | D. | 13.65g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁铝合金的抗腐蚀能力强,不与稀硫酸反应 | |
| B. | Na的金属活动性比Mg的强,故可用Na与MgCl2溶液反应制Mg | |
| C. | 钠可与冷水剧烈反应,而镁与热水才能反应,说明钠比镁活泼 | |
| D. | Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中,Fe也显+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
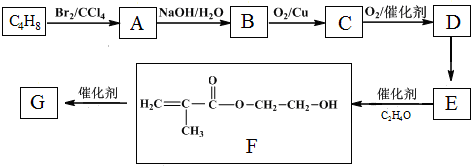
 $\stackrel{O_{2}/Cu}{→}$不能被氧化
$\stackrel{O_{2}/Cu}{→}$不能被氧化
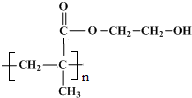 .
.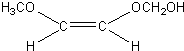 、
、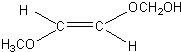 、
、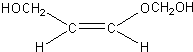 、
、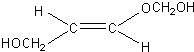 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com