
【题目】下列图示与对应的叙述相符的是( ) 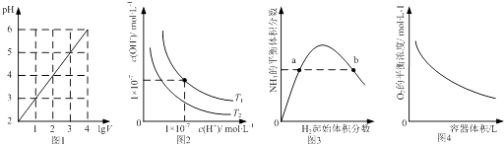
A.图1表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化
B.图2表示不同温度下水溶液中H+和OH﹣浓度的变化的曲线,图中温度T2>T1
C.图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D.图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
【答案】C
【解析】解:A.加水稀释10n倍,促进醋酸的电离,溶液的pH变化小于n个单位,所以1 LpH=2的CH3COOH溶液加水稀释至V L,pH变化小于lgV,故A错误;B.升温促进水电离,Kw增大,水电离的氢离子浓度增大,所以氢离子浓度大的温度高,即温度T2<T1 , 故B错误;
C.增大氢气的浓度,提高氮气的转化率,所以随H2起始体积分数增大,N2的转化率增大,即a点N2的转化率小于b点,故C正确;
D.增大容器的体积,氧气的浓度减小,平衡向正方向移动,氧气的物质的量增大,氧气的浓度先增大,当达到平衡状态时浓度增大,然后随着体积的增大浓度减小,则图像不符,故D错误.
故选C.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对弱电解质在水溶液中的电离平衡的理解,了解当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】下图中甲和乙均是双液原电池装置。判断下列说法不正确的是( )
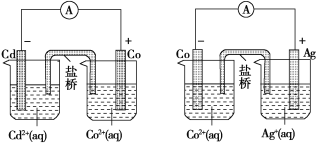
甲 乙
A.甲中电池总反应的离子方程式为Cd(s)+Co2+(aq)===Co(s)+Cd2+(aq)
B.反应2Ag(s)+Cd2+(aq)===Cd(s)+2Ag+(aq)能够发生
C.盐桥的作用是形成闭合回路,并使两边溶液保持电中性
D.乙电池中有1 mol电子通过外电路时,正极有108 g Ag析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷能形成多种含氧酸.
(1)次磷酸(H3PO2)是一种精细化工产品,向10mL H3PO2溶液中加入20mL等物质的量浓度的NaOH溶液后,所得的溶液中只有H2PO2﹣、OH﹣两种阴离子.
①写出H3PO2溶液与足量NaOH 溶液反应后形成的正盐的化学式: , 该正盐溶液中各离子浓度由大到小的顺序为 .
②若25℃时,c(H3PO2)=1×10﹣2 , 则0.01molL﹣1的H3PO2溶液的pH=
(2)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数为K1=1×10﹣2、K2=2.6×10﹣7 .
①试从电离平衡移动的角度解释K1、K2数据的差异
②NaH2PO3溶液显性(填“酸”“碱”或“中”).
(3)25℃时,HF的电离常数为K=3.6×10﹣4; H3PO4的电离常数为K1=7.5×10﹣3 , K2=6.2×10﹣8 , K3=4.4×10﹣13 . 足量NaF溶液和H3PO4溶液反应的离子方程式为
(4)相同温度下,等物质的量浓度的上述三种磷的含氧酸中.c(H+)由大到小的顺序为(用酸的分子式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液稀释至10倍后pH=4
C.0.2 mol/L的盐酸与0.1 mol/L的盐酸等体积水混合后pH=1.5
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】150℃时,NH4HCO3分解为NH3、H2O,CO2三种物质,此时该混合气的密度是相同条件下的氢气密度的()
A. 13.2倍B. 26.3倍C. 15.25倍D. 12倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物异搏定路线中某一步骤如下: 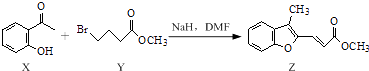
下列说法正确的是( )
A.物质X在空气中不易被氧化
B.物质Y中只含1个手性碳原子
C.物质Z中所有碳原子可能在同一平面内
D.等物质的量的X,Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+ I![]()
![]()
上述平衡体系中,![]() 的物质的量浓度c(
的物质的量浓度c(![]() )与温度T的关系如图所示(曲线上的任何一点都表示平衡状态):
)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态):

(1)通过分析上图,该反应的正反应为 反应(填“吸热”或“放热”)。
(2)在T1温度D状态时,v正 v逆(填“>”“<”或“=”);若在T1时某状态![]() =
=![]() , 平衡状态(填“是”“不是”或“不一定是”)。
, 平衡状态(填“是”“不是”或“不一定是”)。
(3)写出该平衡常数的表达式K = 。若升高温度,K值将 (填“增大”或“减小”或“不变”,下同);若向溶液中加入少量的溴水,K值将 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种治疗认知障碍药物的中间体,可以通过以下方法合成: 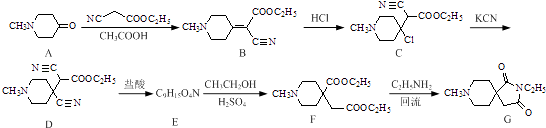
(1)化合物A,D中含氧官能团的名称分别为和 .
(2)由B→C的反应类型为;化合物E的结构简式为 .
(3)写出同时满足下列条件的B的一种同分异构体的结构简式: . ①能发生银镜反应,水解产物之一能与FeCl3溶液发生显色反应;
②分子中只有4种不同化学环境的氢,且分子中含有氨基.
(4)已知:RCN ![]() RCH2NH2 , 请写出以
RCH2NH2 , 请写出以 ![]() 和CH3CH2Cl为原料制备
和CH3CH2Cl为原料制备 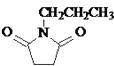 的合成路线流程图(无机试剂任用).合成路线流程图示例如下: CH3CH2OH
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: CH3CH2OH ![]() CH2=CH2
CH2=CH2 ![]() CH3CH2Cl.
CH3CH2Cl.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜与稀硫酸不发生反应,但如果在铜与稀硫酸的混合溶液中加入某种盐,就能使铜溶解,且有气体产生,则该盐是:( )
A. Na2CO3 B. KNO3 C. CuCl2 D. BaCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com