
| A. | 11.2g | B. | 22.4g | C. | 5.6g | D. | 56g |
分析 先根据n=$\frac{V}{{V}_{m}}$计算出N2O的物质的量,再根据电子守恒计算出该反应在消耗铁的物质的量,最后根据m=nM计算出反应中被氧化的铁粉的质量.
解答 解:标准状况下2.24LN2O的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,
生成0.1molN2O转移电子的物质的量为:0.1mol×2×(5-1)=0.8mol,
根据电子守恒,反应中消耗铁粉的物质的量为:$\frac{0.8mol}{2-0}$=0.4mol,
则则反应中被氧化的铁粉质量为:56g/mol×0.4mol=22.4g,
故选B.
点评 本题考查了氧化还原反应的计算,题目难度中等,明确氧化还原反应的实质与特征为解答关键,注意掌握守恒思想在氧化还原反应计算中的应用,试题培养了学生的分析能力及化学计算能力.


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:解答题
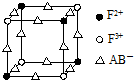 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
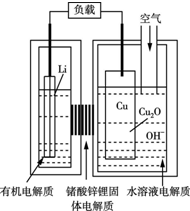 近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH─,下列说法不正确的是( )
近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH─,下列说法不正确的是( )| A. | 放电时,电子通过固体电解质向Cu极移动 | |
| B. | 通空气时,铜被腐蚀,表面产生Cu2O | |
| C. | 放电时,正极的电极反应式为Cu2O+H2O+2e─=2Cu+2OH─ | |
| D. | 整个反应过程中,铜相当于催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
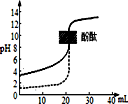
| A. | 反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)在室温下可自发进行,则该反应的△H<0 | |
| B. | 在铜的电解精炼过程中,若转移1mol电子,则阳极溶解32gCu | |
| C. | 常温下向CuS的悬浊液中加入饱和MnSO4溶液可生成MnS沉淀,则Ksp(MnS))<Ksp(CuS) | |
| D. | 常温下用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线(如图)表示的是滴定盐酸的曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
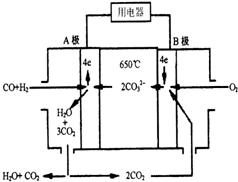 现有一个碳酸盐燃料电池,以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,直接以水煤气(CO、H2的体积比为1:1)为燃料,其工作原理如图所示.
现有一个碳酸盐燃料电池,以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,直接以水煤气(CO、H2的体积比为1:1)为燃料,其工作原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1<△H3 | B. | △H2>△H3 | C. | △H1+△H3=△H2 | D. | △H1+△H2=△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液中的c(NH4+):①>③>② | |
| B. | 等体积pH=a的醋酸与pH=b的NaOH溶液(a+b=14)充分混合时,可能有:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 已知Ka(HClO)=3.0×10-8,Ka(HCN)=6.2×10-10,等体积、等浓度的NaClO、NaCN溶液中,前者中的离子总数小于后者中的离子总数 | |
| D. | 向20mL氨水中加入10mL等浓度的盐酸,有c(NH4+)-c(NH3•H2O)=2[c(OH-)-c(H+)] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
| T2 | 2100 | 869 | 242 | x | x | x | x |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25℃时,pH=7的NH4Cl与NH3•H2O混合溶液中:c(H+)=c(OH-)<c(NH4+)=c(Cl-) | |
| B. | 将pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 向Na2CO3溶液中逐滴滴加稀盐酸时,溶液中c(HCO3-)的变化情况是先变小后变大 | |
| D. | 0.01 mol•L-1Na2CO3溶液与0.01 mol•L-1 NaHCO3溶液等体积混合:3c(CO32-)+3c(HCO3-)+3c(H2CO3)=2c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com