
用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中转移电子的物质的量为
A.0.4 mol B.0.5 mol C.0.6 mol D.0.8 mol
科目:高中化学 来源:2015-2016学年广东省高一上学期9月月考化学试卷(解析版) 题型:填空题
(1)CCl4和蒸馏水都是无色液体,请按下列要求用实验方法鉴别之(简要地写出实验过程)
① 只允许用一种试剂________________
② 不用任何试剂________________
(2)NaCl溶液中含有少量的CaCl2,某学生用过量的Na2CO3使Ca2+离子转化为沉淀而除去,确认Na2CO3已过量的实验方法是________________
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上学期第一次月考化学试卷(解析版) 题型:选择题
化学科学的特征是
A.研究物质的变化 B.制造新物质
C.认识分子和制造分子 D.做实验
查看答案和解析>>
科目:高中化学 来源:2016届江苏省淮安市高三上学期9月月考化学试卷(解析版) 题型:选择题
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的n(PCl3)随时间的变化如右图,下列说法正确的是
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的n(PCl3)随时间的变化如右图,下列说法正确的是
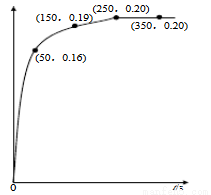
A.反应在前50 s 的平均速率v(PCl5)=0.0032 mol·L-1·s-1
B.该反应的平衡常数K= 0.025
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20molPCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D.保持其他条件不变,升高温度,平衡时:c(PCl3)=0.11mol·L-1,则反应的△H<0
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期第二次月考理综化学试卷(解析版) 题型:选择题
Al、Fe、Cu都是重要的金属元素。下列说法正确的是
A.三者对应的氧化物均为碱性氧化物
B.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
C.三者的单质放置在空气中均只生成氧化物
D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
在密闭容器中进行如下反应:X2(g)+Y2(g)  2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A. Z为0.3mol/L B. Y2为0.4mol/L
C. X2为0.2mol/L D. Z为0.4mol/L
查看答案和解析>>
科目:高中化学 来源:2016届湖南省常德市高三上学期10月月考化学试卷(解析版) 题型:选择题
等物质的量的过氧化钠与碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却残留的固体物质是
A.NaOHNa2CO3 B.Na2CO3
C.Na2O2Na2CO3 D.NaHCO3Na2CO3
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上学期二次模拟测试理综化学试卷(解析版) 题型:选择题
1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.得到2.54 g沉淀时,加入NaOH溶液的体积是60 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期第一次月考化学试卷(解析版) 题型:选择题
工业上制备氯化铜时,是将浓盐酸用蒸汽加热至80 ℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下: CuO+2HCl=CuCl2+H2O;FeO+2HCl=FeCl2+H2O。已知: 当pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀; pH≥6.4时, Cu2+以Cu(OH)2形式完全沉淀;pH在3~4时, Fe3+以Fe(OH)3形式完全沉淀。除去溶液中的Fe2+可以采用的方法是
A.直接加碱,调整溶液pH≥9.6
B.加纯铜粉,将Fe2+还原出来
C.先将Fe2+氧化Fe3+成再调整pH至3~4
D.通入硫化氢,使Fe2+直接沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com