
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。 (1)T业上用黄铁矿(FeS2)在高温下和氧气反应制备SO2:4FeS2+11O2 8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率(已知SO3。熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响)。
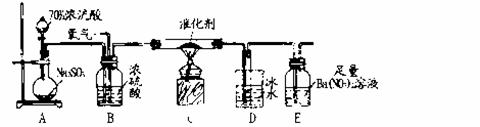
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是______。
②当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是______。
③实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是______(用含字母的代数式表示,不用化简)。
(3)某兴趣小组欲在绿色环保的条件下探究SO2的性质,设计如下图实验装置。
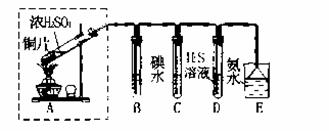
B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为_______;
C中反应的离子方程式为______ ;D中的实验现象为______ ;E装置的作用是______。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
二甲醚是一种绿色、可再生的新能源。图5是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔
性Pt电极)。该电池工作时,下列说法不正确的是
A.a电极为该电池负极
B.O2在b电极上得电子,被氧化
C.电池工作时,a电极反应式:
CH3OCH3—12e-+3H2O→2CO2↑+12H+
D.电池工作时,燃料电池内部H+从a电极移向b电极

查看答案和解析>>
科目:高中化学 来源: 题型:
有1H、D、T三种原子:
(1)在标准状况下,它们的单质的密度之比是 ;
(2)1mol各种单质中,它们的质子数之比是 ;
(3)1g各种单质中它们的中子数之比是 ;
(4)在标准状况下,1L各种单质中,它们的电子数之比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列实验事实:①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;②将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝;③向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液。下列判断不正确的是
A.化合物KCrO2中Cr元素为+3价 B.实验①证明Cr2O3是两性氧化物
C.实验②证明氧化性:Cr2O72->I2 D.实验③证明H2O2既有氧化性又有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应实验,能达到实验目的的是( )

A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g) 3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
A.升高温度,平衡常数增大
B.W点X的正反应速率等于M点X的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com