
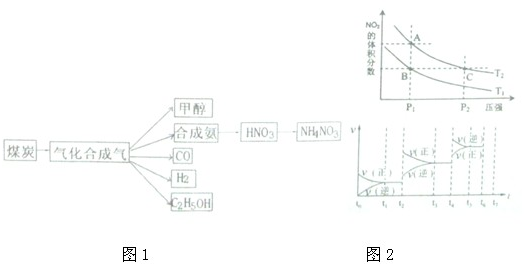
ͼһ��ú������ҵ����һ���֣���������ѧ֪ʶ���ش��������⣺
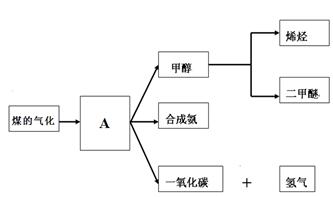
ͼһ
��1��ͼһ������A���׳���_______________
��2���ϳɰ���ҵ��ú������ҵ���зdz���Ҫ��һ������֪��һ�����ݣ��ƻ�1mol�����еĻ�ѧ����Ҫ����946 kJ�������ƻ�0.5mol�����е�H-H����Ҫ����218kJ���������γɰ�������1 mol N-H���ܹ��ͷ�389kJ������ͼ����ʾ�ϳɰ���ҵ�����������ı仯���뽫ͼ�Т١��ڵ������仯����ֵ�������±ߵĺ����ϡ�
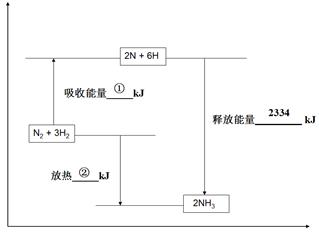
ͼ��
�� kJ ���� kJ
��3��ú������ҵ����Ҫ��Ʒ֮һ�״�����һ�����͵���������ȼ�ϣ�������ҵ�һ��ͨ��CO��H2�����Ʊ��״�,�÷�Ӧ�Ļ�ѧ����ʽΪ��CO (g) + 2H2(g) CH3OH(g)
CH3OH(g)
��������������˵��������Ӧ�Ѵ�ƽ�����_______��
A. �����������ƽ��Ħ���������ֲ���
B. 2v(H2)�� = v(CH3OH)��
C. �����������ѹǿ���ֲ���
D. ��λʱ��������n molCO��ͬʱ����2n mol H2
�����ݻ��̶��ĺ����ܱ������г���CO��H2����������Ӧ����Ӧ�ڵ�4 minʱ��ﵽ���ȣ���ʱ������ѹǿ�뷴Ӧǰ֮��Ϊ3�U5�����������ʵĸ������ʵ���Ũ�����±���
|
ʱ��/Ũ�� |
c(CO)(mol/L) |
C(H2 )(mol/L) |
c(CH3OH)(mol/L) |
|
��ʼ |
0.200 |
0.300 |
0.000 |
|
��4 min |
a |
b |
c |
��b=__________________
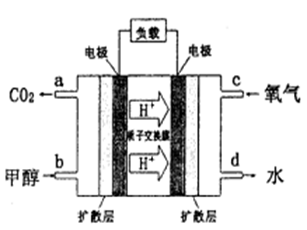
��4���״�������ȼ�ϵ�أ�DMFC)��һ�ָ�Ч�ܡ�����Ⱦ�綯�����ij��ص�أ��乤��ԭ������ͼ��ʾ����ȼ�ϵ�صĵ�ط�ӦʽΪ2CH3OH (g) + 3O2(g) =
2CO2(g) + 4H2O(l)�����ĵ缫��ӦʽΪ______________________����������pHֵ_______________(��д����������С�����ߡ����䡱)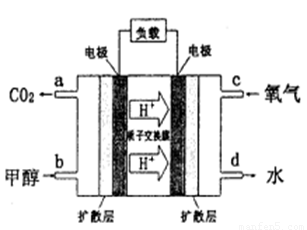
��1��ˮú�� ��2�� �� 2254 �� 80 ��3�� A��C 0.100
��4��CH3OH-6e- +H2O=CO2+6H+ ����
��������
�����������2�������յ�����=946+218��6= 2254KJ���ڷų�������=2254-2334=80KJ
��3���ٸ÷�Ӧǰ�����������������ȣ��ʵ�ƽ�����Ħ��������ѹǿ����ʱ����Ӧ�ﵽ��ƽ��״̬��v(H2)��
= 2v(CH3OH)��Ҳ�ܱ�ʾ��Ӧ�ﵽƽ��״̬����Dѡ���ʾ�淴Ӧ�����ܱ�ʾ��Ӧ�ﵽƽ��״̬�����跴Ӧ�����У�CO��ת��Ũ��Ϊx��H2Ϊ2x���״�Ϊx����CO��ƽ��Ũ��Ϊ��0.2-x����H2��ƽ��Ũ��Ϊ��0.3-2x�����״���ƽ��Ũ��Ϊx,��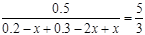 ����ã�x=0.100����4����������������Ӧ������������ԭ��Ӧ�������ĵ缫��Ӧʽ��O2+4e-+4H+=2H2O����������pHֵ����
����ã�x=0.100����4����������������Ӧ������������ԭ��Ӧ�������ĵ缫��Ӧʽ��O2+4e-+4H+=2H2O����������pHֵ����
���㣺��ѧ�뻯������
���������������ǹ�ҵ����Ҫ��ҵ���������߿����ȵ㣬�����ڱ���������Ӧע��֪ʶ��������ã��ﵽ��һ������Ч�����ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| [H2][CO] |
| [H2O] |
| ������� | n��C��mol | n��H2O��mol | n��CO��mol | n��H2��mol | v����v���Ƚ� |
| �� | 0.2 | 0.12 | 1.20 | 0.20 | v��=v�� |
| �� | 0.16 | 0.20 | 0.40 | 0.80 | v�� �� �� v�� |
| 0.2��0.4 |
| 0.1 |
| 0.2��0.4 |
| 0.1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| C(H2)?C(CO) |
| C(H2O) |
| ���� |
| ���� |
| ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ������һ�и�һ��ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ������
ͼһ��ú������ҵ����һ���֣���������ѧ֪ʶ���ش��������⣺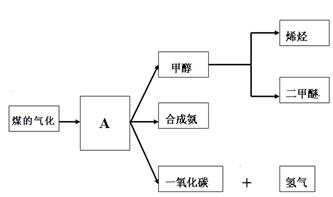
ͼһ
��1��ͼһ������A���׳���_______________
��2���ϳɰ���ҵ��ú������ҵ���зdz���Ҫ��һ������֪��һ�����ݣ��ƻ�1mol�����еĻ�ѧ����Ҫ����946 kJ�������ƻ�0.5mol�����е�H-H����Ҫ����218kJ���������γɰ�������1 mol N-H���ܹ��ͷ�389kJ������ͼ����ʾ�ϳɰ���ҵ�����������ı仯���뽫ͼ�Т١��ڵ������仯����ֵ�������±ߵĺ����ϡ� 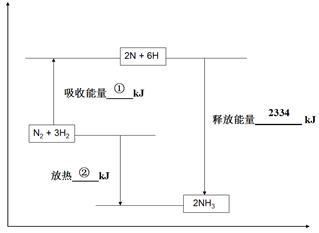
ͼ��
�� kJ ���� kJ
��3��ú������ҵ����Ҫ��Ʒ֮һ�״�����һ�����͵���������ȼ�ϣ�������ҵ�һ��ͨ��CO��H2�����Ʊ��״�,�÷�Ӧ�Ļ�ѧ����ʽΪ��CO (g) + 2H2(g) CH3OH(g)
CH3OH(g)
��������������˵��������Ӧ�Ѵ�ƽ�����_______��
A. �����������ƽ��Ħ���������ֲ���
B. 2v(H2)�� = v(CH3OH)��
C. �����������ѹǿ���ֲ���
D. ��λʱ��������n molCO��ͬʱ����2n mol H2
�����ݻ��̶��ĺ����ܱ������г���CO��H2����������Ӧ����Ӧ�ڵ�4 minʱ��ﵽ���ȣ���ʱ������ѹǿ�뷴Ӧǰ֮��Ϊ3�U5�����������ʵĸ������ʵ���Ũ�����±���
| ʱ��/Ũ�� | c(CO)(mol/L) | C(H2 )(mol/L) | c(CH3OH)(mol/L) |
| ��ʼ | 0.200 | 0.300 | 0.000 |
| ��4 min | a | b | c |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
ͼһ��ú������ҵ����һ���֣���������ѧ֪ʶ���ش��������⣺
��1��ͼһ������A���׳���_______________
��2���ϳɰ���ҵ��ú������ҵ���зdz���Ҫ��һ������֪��һ�����ݣ��ƻ�1mol�����еĻ�ѧ����Ҫ����946 kJ�������ƻ�0.5mol�����е�H-H����Ҫ����218kJ���������γɰ�������1 mol N-H���ܹ��ͷ�389kJ������ͼ����ʾ�ϳɰ���ҵ�����������ı仯���뽫ͼ�Т١��ڵ������仯����ֵ�������±ߵĺ����ϡ� ����������
������ ������ kJ �������� ������ kJ
��3��ú������ҵ����Ҫ��Ʒ֮һ�״�����һ�����͵���������ȼ�ϣ�������ҵ�һ��ͨ��CO��H2�����Ʊ��״�,�÷�Ӧ�Ļ�ѧ����ʽΪ��CO (g) + 2H2(g)![]() CH3OH(g)
CH3OH(g)
��������������˵��������Ӧ�Ѵ�ƽ�����_______��
A. �����������ƽ��Ħ���������ֲ���
B. 2v(H2)�� = v(CH3OH)��
C. �����������ѹǿ���ֲ���
D. ��λʱ��������n molCO��ͬʱ����2n mol H2
�����ݻ��̶��ĺ����ܱ������г���CO��H2����������Ӧ����Ӧ�ڵ�4 minʱ��ﵽ���ȣ���ʱ������ѹǿ�뷴Ӧǰ֮��Ϊ3�U5�����������ʵĸ������ʵ���Ũ�����±���
| ʱ��/Ũ�� | c(CO)(mol/L) | c(H2 )(mol/L) | c(CH3OH)(mol/L) |
| ��ʼ | 0.200 | 0.300 | 0.000 |
| ��4 min | a | b | c |
��b=__________________
��4���״�������ȼ�ϵ�أ�DMFC)��һ�ָ�Ч�ܡ����� Ⱦ�綯�����ij��ص�أ��乤��ԭ������ͼ��ʾ����ȼ�ϵ�صĵ�ط�ӦʽΪ2CH3OH (g) + 3O2(g) = 2CO2(g) + 4H2O(l)�����ĵ缫��ӦʽΪ______________________����������pHֵ_______________(��д����������С�����ߡ����䡱)
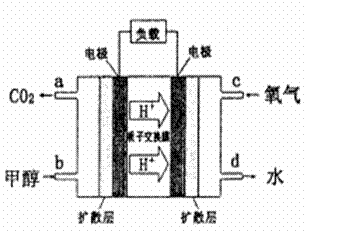
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com