
分析 根据电解原理和溶液中的阴阳离子的放电顺序,书写阴阳极的电极反应,结合电极上电子转移相同进行计算.
解答 解;以惰性电极电解CuSO4溶液,在阳极上氢氧根离子放电生成氧气,阴极上铜离子得到电子析出金属铜,阳极电极反应:4OH--4e-=2H2O+O2↑;阴极电极反应:Cu2++2e-=Cu、2H++2e-=H2↑,阴极析出铜的质量6.4g,物质的量是0.1mol,所以n(Cu2+)=n(CuSO4)=0.1mol,转移电子是0.2mol,产生2.24L即0.1mol气体氢气,转移电子是0.2mol,所以转移电子是0.4mol,阳极上生成0.1mol氧气,体积是:0.1mol×22.4L/mol=2.24L,CuSO4溶液的c=$\frac{0.1mol}{0.1L}$=1mol/L.故答案为:1mol/L;2.24L.
点评 根据电解原理和溶液中的阴阳离子的放电顺序,书写阴阳极的电极反应,结合电极上电子转移相同进行计算.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.2molNa2O2中含有0.4NA个阴离子 | |
| B. | 常温常压下,0.2molSi与足量NaOH溶液反应,转移电子的数目为0.2NA | |
| C. | 物质的量浓度为0.5mol/L的FeCl3溶液中,含有Cl-个数为1.5NA | |
| D. | 常温常压下,1.06g Na2CO3中含有的Na+离子数为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):NN键为942、O=O键为500、O-H键为463,则断裂1mol N-H键所需的能量是( )
有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):NN键为942、O=O键为500、O-H键为463,则断裂1mol N-H键所需的能量是( )| A. | 658 | B. | 516 | C. | 391 | D. | 194 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
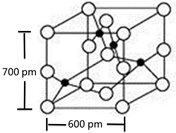 X、Y、M、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;M是周期表中电负性最大的元素;Z基态原子的M层是K层电子数的3倍;R2+离子的3d轨道中有9个电子.请回答下列问题:
X、Y、M、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;M是周期表中电负性最大的元素;Z基态原子的M层是K层电子数的3倍;R2+离子的3d轨道中有9个电子.请回答下列问题: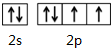 ;Z所在周期中第一电离能最大的主族元素是氯(元素名称)
;Z所在周期中第一电离能最大的主族元素是氯(元素名称)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com