
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要,广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O。正极电极反应为__________。
(2)某学习小组依据氧化还原反应:2Ag++Cu===Cu2++2Ag设计成原电池,则负极发生的电极反应为 ________,当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移了的电子数目是_________。
(3)燃料电池是一种高效、环境友好的供电装置,如下图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:

①该电池的正极反应式__________________________。
②若该电池的效率80%,当外电路通过0.2mo1电子时,消耗O2的体积____L(标准状况)
【答案】PbO2+4H++SO42-+2e-=PbSO4+2H2O Cu-2e=Cu2+ 0.05NA O2+4e-+4H+=2H2O 1.4
【解析】
(1)根据铅蓄电池中正极得到电子发生还原反应生成硫酸铅,写出电极方程式;
(2)根据总反应可知铜发生氧化反应,则铜失电子作原电池的负极;Ag为原电池的正极,正极上发生还原反应,根据电极反应式计算转移电子的数目;
(3)氢氧燃料电池中,通入氧气的一极为正极,发生还原反应;根据原电池中得失电子数目相等进行计算。
(1)铅蓄电池的电池总反应式为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,依据反应的总电池反应,反应中PbO2中元素化合价降低的是在正极得到电子发生还原反应生成硫酸铅,电极反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;故答案为:PbO2+2e-+4H++SO42-=PbSO4+2H2O。
(2)在2Ag++Cu═Cu2++2Ag反应中,铜的化合价升高,发生氧化反应,则铜失电子作原电池的负极,电极反应为Cu-2e-═Cu2+;原电池工作时,负极铜失去电子被氧化生成铜离子,铜的质量逐渐减少,溶液中的银离子在正极银得电子发生还原反应生成银,所以正极增重的质量就是析出银的质量,当银电极质量增加5.4g时,n(Ag)=5.4g÷108g/mol =0.05mol,根据电极反应Ag++e-=Ag,可知原电池反应共转移电子的数目为0.05NA,故答案为:Cu-2e-═Cu2+;0.05NA。
(3)①氢氧燃料电池中,通入氧气的一极为正极,发生还原反应,该电池的正极方程式为:O2+4e-+4H+=2H2O;故答案为:O2+4e-+4H+=2H2O。
②设参加反应的氧气的体积为VL(标准状况),则![]() ×80%×4mol=0.2mol,解得V=1.4L,故答案为:1.4。
×80%×4mol=0.2mol,解得V=1.4L,故答案为:1.4。


科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如下图所示。下列说法正确的是
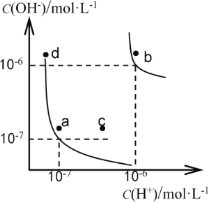
A. 图中对应点的温度关系为: a>b
B. 水的电离常数KW数值大小关系为:b>d
C. 温度不变,加入少量NaOH可使溶液从c点变到a点
D. 在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (x)、
(x)、 (y)、
(y)、![]() (z)的分子式均为C8H8,下列说法正确的是
(z)的分子式均为C8H8,下列说法正确的是
A. y的二氯代物有3种 B. x、y和z均能与溴水发生反应
C. z中的所有原子在同一平面上 D. x的同分异构体只有y和z两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g![]() Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应,下列叙述正确的是( )
Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应,下列叙述正确的是( )
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C. 反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03 mol·L-1·min-1
D. 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是( )
A. 在a mol金刚石中含有C—C键的个数为N= 2a×6.02×1023
B. 热稳定性:MgCO3 > CaCO3
C. 熔点:MgO < MgCl2
D. 沸点:Na < K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是制取溴苯的装置。回答下列问题:
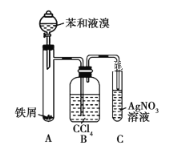
(1)装置A中发生反应的化学方程式是______________、______________。
(2)装置C中观察到的现象是______________,证明____________。
(3)装置B是吸收瓶,瓶内盛有CCl4,实验中观察到的现象是_________________,原因是___________________;如果没有装置B,将装置A、C直接相连,则该套实验装置_________(填“合理”或“不合理”),原因是___________。
(4)实验完毕后,将装置A试管中的液体倒入盛有冷水的烧杯中,烧杯_______(填“下”或“上”)层为溴苯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡(SnCl4)是一种重要的化工产品,可在加热下直接氯化来制备。已知:四氯化锡是无色液体,熔点-33 ℃,沸点114 ℃。SnCl4 极易水解,在潮湿的空气中发烟。实验室可以通过下图装置制备少量SnCl4 (夹持装置略)。
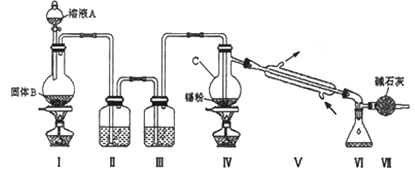
(1)装置Ⅰ中发生反应的离子方程式为________;
(2)装置Ⅱ中的最佳试剂为_______,装置Ⅶ的作用为_______;
(3)该装置存在的缺陷是:_______________;
(4)如果没有装置Ⅲ,在Ⅳ中除生成SnCl4外,还会生成的含锡的化合物的化学式为_______________;
(5)实验用锡粒中含有杂质Cu.某同学设计下列实验测定锡粒的纯度.
第一步:称取0.613g锡粒溶入足量盐酸中,过滤;
第二步:向滤液中加入过量FeCl3溶液,将Sn2+氧化成Sn4+;
第三步:用0.100 molL-1 K2Cr2O7溶液滴定生成的Fe2+,发生反应的表达式为(未配平):Fe2+ + Cr2O72- + H+→Cr3+ + Fe3+ + H2O
第二步中发生反应的离子方程式是 _______________,若达到滴定终点时共消耗16.0 mLK2Cr2O7溶液,试写出试样中锡的质量分数的计算式____________(仅写计算结果,锡的相对原子质量按119计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示从混合物中分离出X的两种方案,根据方案I和方案Ⅱ指出下列说法合理的是
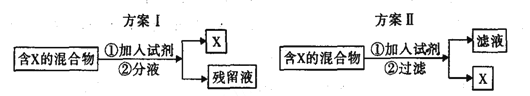
A.若含X的混合物为溴水,可通过方案I进行分离,加入试剂为CC14液体,充分振荡后液体分层,上层为X的CC14溶液
B.若含X的混合物为苯和苯酚,可通过方案Ⅱ进行分离,加入试剂为浓溴水,X为三溴苯酚
C.若含X的混合物为皂化反应后的混合物,可通过方案I进行分离,加入试剂为饱和食盐水,残留液中含有甘油
D.若含X的混合物为Fe、Al,可通过方案II进行分离,加入试剂为过量NaOH溶液,1mol X与足量氯气完全反应时,转移3mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)[化学——选修5:有机化学基础]
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
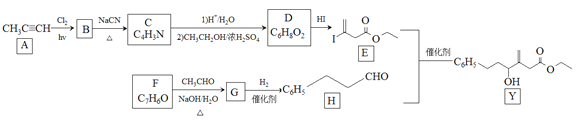
已知:![]()
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com