
0.1mol下列气体分别与1L0.lmol·L-1的NaOH溶液反应,形成的溶液pH最小的是
A. NO2 B.SO2 C.SO3 D.CO2
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
(1)在一体积为10 L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
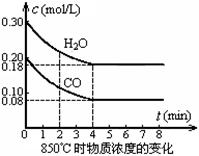 CO(g) + H2O(g)
CO(g) + H2O(g)  CO2(g) + H2(g) △H <0
CO2(g) + H2(g) △H <0
CO和H2O浓度变化如图,则0~4 min的平均反应速率v (CO)=____________mol / (L·min)
(2)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
| 时间(min) | 0 | 2 | 3 | 4 | 5 | 6 |
| CO | 0.200 | 0.138 | C1 | C1 | 0.116 | 0.096 |
| H2O | 0.300 | 0.238 | C2 | C2 | 0.216 | 0.266 |
| CO2 | 0 | 0.062 | C3 | C3 | 0.084 | |
| H2 | 0 | 0.062 | C3 | C3 | 0.104 |
① 表中3 min ~ 4 min之间反应处于_________状态;
C1数值________0.08mol / L(填大于、小于或等于)。
② 反应在4 min ~ 5 min问,平衡向逆方向移动,可能的原因是________(单选),
表中5 min ~ 6 min之间数值发生变化,可能的原因是________(单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有( )
| 序号 | X | Y | Z | W |
|
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.①②③ B.①③④ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关“化学与生活”的叙述不正确的是
A、 点燃爆竹后,硫燃烧生成SO3
B、 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
C、 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒
D、 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
扁桃酸衍生物是重要的医药中间体,以A和B 为原料合成扁桃酸衍生物F路线如下:
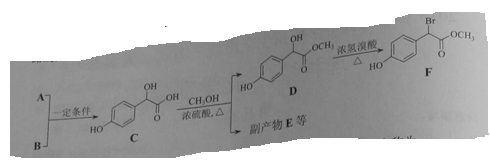
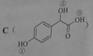
(1)A的分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团名称为:_________,写出A+B→C的化学反应方程式为__________________________.
(2)  中①、②、③3个—OH的酸性有强到弱的顺序是:_____________。
中①、②、③3个—OH的酸性有强到弱的顺序是:_____________。
(3)E是由2分子C生成的含有3个六元环的化合物,E的分子中不同化学环境的氢原子有________种。
(4)D→F的反应类型是__________,1mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为:________mol .
写出符合下列条件的F的所有同分异构体(不考虑立体异构)的结构简式:______
①、属于一元酸类化合物,②、苯环上只有2个取代基且处于对位,其中一个是羟基
(5)已知:
A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)合成路线流程图示例如下:
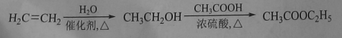
查看答案和解析>>
科目:高中化学 来源: 题型:
10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是
A.K2SO4 B.CH3COONa C.CuSO4 D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是 。
(2)已知Ksp(AgCl)=1.8×10-10,若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸,混合后溶液中的Ag+的浓度为 mol·L-1,pH为 。
(3)AgNO3溶液光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为 。
(4)右图所示原电池正极的反应式为 。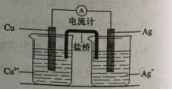
查看答案和解析>>
科目:高中化学 来源: 题型:
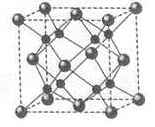
.[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 .。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a= 0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在10 L的密闭容器中进行反应N2(g) + 3H2(g) 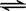 2NH3(g),2 min末N2的物质的量由20 mol减小到8 mol,则2 min末N2的反应速率为
2NH3(g),2 min末N2的物质的量由20 mol减小到8 mol,则2 min末N2的反应速率为
A.1.2 mol/(L·min) B.1 mol/(L·min)
C.0.6 mol/(L·min) D.0.4 mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com