
(15分).钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。工业上常以钛矿石(主要成分为FeTiO3(钛酸亚铁),并含FeO、A12O3、 SiO2等杂质)为主要原料经过以下流程制得TiO2,并获得副产品FeSO4·7H2O.
请回答下列问题:
(l)步骤I的目的是
(2)写出步骤Ⅱ中FeTiO3与H2SO4反应的化学方程式 。
(3)步骤II中经过 、 、过滤、洗涤等操作可以得到FeSO4·7H2O.晶体,还可以利用酸化的FeSO4溶液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水).该反应的离子方程式为
(4)请结合化学用语用化学平衡理论解释步骤III中将TiOSO4转化为H2TiO3的原理:
(5)为测定步骤II后溶液中TiOSO4的含量,首先取待测钛液10 mL加水稀释至100 mL,再加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,以KSCN溶液为指示剂,用0.1000 mol·L-1 NH4Fe(SO4)2溶液滴定至终点,再重复2次,测得平均值为30.00mL。
①该滴定达到终点时的现象
②待测钛液中TiOSO4的物质的量浓度是 。
科目:高中化学 来源: 题型:单选题
对于常温下pH为2的盐酸,叙述正确的是
| A.溶液中c(H+)=c(Cl—) |
| B.与等体积pH=12的氨水混合后所得溶液显酸性 |
| C.由盐酸电离出的H+约为由H2O电商出H+浓度的l010倍 |
| D.与等体积0.01 moI·L-1碳酸钠溶液混合后所得溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)现有浓度为0.lmol/L的五种电解质溶液:①Na2CO3②NaHCO3③NaAlO2④CH3COONa⑤NaOH
已知:
(1)上述五种溶液的pH由大到小的顺序为________。(填序号)
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是________。(填序号)
(3)在上述五种溶液中分别加入AlCl3溶液后,能产生无色气体的是_______:(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)元素及其化合物在生产、生活中具有广泛的用途。
Ⅰ.铬化学丰富多彩:
⑴在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液。与铜相比,其金属活泼性 。(填“强”或“弱”)
⑵Cr( OH)3和Al( OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,其酸式电离方程式是 。
(3)工业上净化处理铬污染方法之一:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[ Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×l0-31)。已知电解后的溶液中c( Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 mol/L。
Ⅱ.物质A~H有如图所示转化关系(部分生成物未列出)。A、E、F、G均为气体,D为贵重金属之一。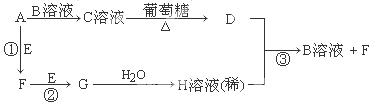
请回答下列问题:
(1)A分子是 分子(填“极性”或“非极性”),C溶液中的阳离子是 (写化学式,不考虑水的电离)。
(2)反应①的化学方程式为 ;反应③的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)常温下,某水溶液中存在的离子有:Na+、B2-、HB-、H+、OH-,存在的分子有H2O、H2B。根据题意回答下列问题:
(1)写出酸H2B的电离方程式 ﹑ 。
(2)常温下,已知0.1 mol·L-1二元酸H2B溶液中c(OH-) / c(H+)=1×10-6。
①常温下,0.1 mol·L-1H2B溶液的pH= ;
②写出该酸(H2B)与少量NaOH溶液反应的离子方程式: ;
(3)常温下,将100 mL 0.1 mol·L-1的稀H2SO4溶液与100 mL 0.4 mol·L-1的NaOH溶液充分混合(溶液体积变化忽略不计),所得溶液的pH= 。
(4)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw= 。该温度下(t℃),0.1 mol·L-1HCl溶液的pH= ;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液中c(H+)= 。
(2)HA的电离平衡常数K= ;
(3)升高温度时,K (填“增大”,“减小”或“不变”)。
(4)由HA电离出的c(H+)约为水电离出的c(H+)的 倍。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知某溶液中只存在OH-.H+.NH4+.Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种,请回答后面问题:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)上述关系一定不正确的是 (填序号)
(2)若溶液中只有一种溶质,则该溶质为 ,该溶液中离子浓度的大小关系为 (填序号)
(3)若关系③正确,则溶液中溶质为 。
(4)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显 (填“酸性”、“碱性”、“中性”)。
(5)25℃,pH="a" 的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va Vb(填>、<、=、无法确定)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则(用“>”、“<”或“=”填写下列空白):
(1)混合溶液中c(A-)______c(HA);
(2)混合溶液中c(HA)+c(A-)______0.1 mol·L-1;
(3)混合溶液中由水电离出的c(OH-)__________0.2 mol·L-1HA溶液中由水电离出的
c(H+);
(4)25°C时,如果取0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合,测得混合溶液的pH<7,则HA的电离程度______NaA的水解程度。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是几种常见弱酸的电离平衡常数(25 ℃)。
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.76×10-5 |
| H2CO3 | H2CO3 H++HCO3— H++HCO3—HCO3—  H++CO32— H++CO32— | K1=4.4×10-7 K2=4.7×10-11 |
| H2S | H2S H++HS- H++HS-HS-  H++S2- H++S2- | K1=1.3×10-7 K2=7.1×10-15 |
| H3PO4 | H3PO4 H++H2PO4— H++H2PO4—H2PO4—  H++HPO42— H++HPO42—HPO42—  H++PO43— H++PO43— | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com