
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是( )
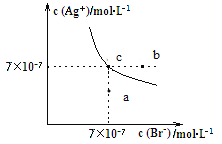
A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制备NaClO2的工艺流程如下图所示:

下列说法不正确的是
A. 工业上可将ClO2制成NaClO2固体,便于贮存和运输
B. 通入空气的目的是驱赶出ClO2,使其被吸收器充分吸收
C. 吸收器中生成 NaClO2的离子方程式:2ClO2+H2O2=2ClO2-+O2↑+2H+
D. 步骤a的操作包括过滤、洗涤和干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A. 氯水的颜色呈浅黄绿色,说明氯水中含有![]()
B. 干燥氯气与湿润氯气漂白性的对比实验证明,氯水中具有漂白性的微粒是![]()
C. 向氯水中加入![]() 粉末,有气泡产生,说明氯水中含有
粉末,有气泡产生,说明氯水中含有![]()
D. 向![]() 溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有
溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废铁屑(含有少量镍)制备高铁酸钾(K2FeO4)的流程如下图所示:
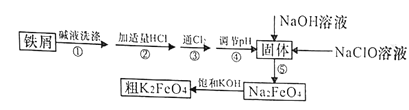
已知:25℃时,一些金属氢氧化物开始沉淀和完全沉淀时的pH如下表所示:
M(OH)m | PH | |
开始沉淀 | 沉淀完全 | |
Fe (OH)3 | 2.53 | 2.94 |
Ni(OH)2 | 7.60 | 9.75 |
(1)K2FeO4中铁元素的化合价为________________。
(2)“碱液洗涤”的目的是除去铁屑表面的油污,实际一般选用Na2CO3溶液除污,选用Na2CO3溶液除污的原理是____________________________(用离子方程式表示)。
(3)步骤③发生反应的离子方程式为___________________。
(4)步骤⑤是将Fe(OH)3固体氧化为Na2FeO4,同时NaClO转化为NaCl。则生成1mol Na2FeO4消耗NaClO的质量为______g;步骤④调节pH的范围是_______。
(5)用滴定法测定所制粗K2FeO4的纯度(杂质与KI不反应):取0.220g粗K2FeO4样品,加入足量硫酸酸化的KI溶液,充分反应后,用0.200mol·L-1Na2S2O3标准溶液滴定生成的I2,滴定消耗标准溶液的体积为20.00mL。涉及的反应有:FeO42-+4I-+8H+=Fe2++2I2+4H2O,2S2O32-+I2=S4O62-+2I-。
①滴定时选用的指示剂为______,滴定终点的现象为_____________。
②粗K2FeO4的纯度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯化钠晶胞(如图)的说法正确的是( )
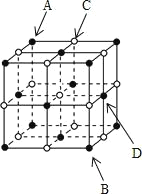
A.每个晶胞含有6个Na+和6个Cl-
B.晶体中每个Na+周围有8个Cl-,每个Cl-周围有8个Na+
C.晶体中与每个Na+最近的Na+有8个
D.将晶胞沿体对角线AB作投影,CD两原子的投影将相互重合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是 ( )
A.Na2CO3+2HCl=2NaCl+CO2↑+H2OB.CaO+H2O=Ca(OH)2
C.2CO+O2![]() 2CO2D.CaCO3
2CO2D.CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
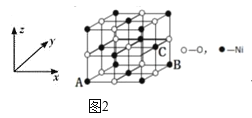
【题目】元素C与过渡元素Co、Fe、Ni等在工业、农业、科学技术以及人类生活有机合成等方面有重要作用。
(1)基态Co原子价电子轨道排布图为______,第四电离能I4(Co)<I4(Fe),其原因是______。
(2)(CH3)3C+是有机合成重要中间体,该中间体中碳原子杂化方式为______。
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+,其原因是______。
(4)Co的一种氧化物的晶胞如图1。己知钴原子的半径为apm,氧原子的半径为bpm,它们在晶体中是紧密接触的,在该钴的氧化物晶胞中原子的空间利用率为______(列出含a、b的计算表达式即可)(提示:条件不足,无法判断钴原子之间是否紧密接触)。
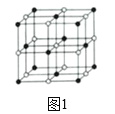
(5)NiO的晶体结构如图2所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,1LC2H5OH完全燃烧后生成的CO2分子个数约为![]()
B.20gD2O与20gH218O含有的中子数均为10NA
C.1mol·L-1Al(NO3)3溶液中含有3NA个NO3-
D.50mL12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com