
| A、有1mol H-H键断裂,同时有1 mol I-I键形成 |
| B、容器内压强不再随时间而变化 |
| C、υ正(H2)=υ逆(HI) |
| D、H2、I2、HI的浓度之比为1:1:2 |


科目:高中化学 来源: 题型:
| A、标准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA |
| B、0.1 mol?L-1的AlCl3溶液与足量NaOH溶液反应所得产物中含AlO2-为0.1NA |
| C、足量Zn与浓硫酸共热可生成标准状况下的气体2.24 L,则参加反应的硫酸为0.4 NA |
| D、常温常压下,5.6g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
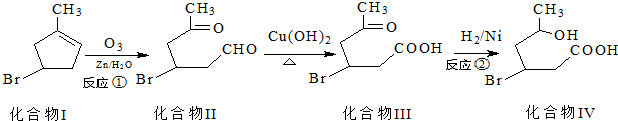
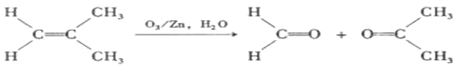
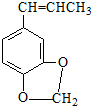 )发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为
)发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
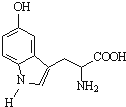
| A、该有机物分子式为C11H12N2O3 |
| B、该有机物分子中所有原子不可能共平面 |
| C、分子中含有1个手性碳原子 |
| D、1mol该物质最多可与4molH2或1molBr2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Cl-、CH3COO-、NO3- |
| B、K+、AlO2-、NO3-、OH- |
| C、Fe3+、I-、SO42-、H+ |
| D、AlO2-、HCO3-、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
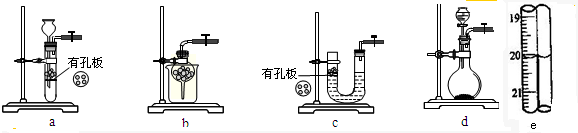
| 编号 | 1 | 2 | 3 |
| 消耗KI3溶液的体积/mL | 19.98 | 20.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 待测液数据/mL | 标准液数据/mL | ||
| 滴定前 | 滴定后 | 取用前 | 取用后 | |
| 1 | 0.10 | 20.10 | 0.00 | 20.00 |
| 2 | 0.80 | 22.60 | 0.00 | 20.00 |
| 3 | 0.40 | 20.20 | 0.00 | 20.00 |
| 4 | 1.20 | 21.40 | 0.00 | 20.00 |
| A、0.1000 mol/L |
| B、0.0978 mol/L |
| C、0.9780 mol/L |
| D、0.1020 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,
,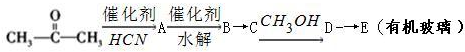
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com