
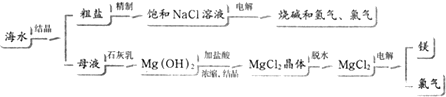
分析 (1)海水获取淡水的方法由学过的知识可知:从海水中得到淡水,主要采用的方法是蒸馏法中的多级闪急蒸馏法,渗析法、离子交换法;
(2)海水获取淡水通过蒸馏得到,海水蒸发制海盐的过程是物理变化过程,常温下呈液体的非金属单质为溴单质;
(3)根据各步反应结合物质的性质判断所发生的反应,以此判断反应类型.
解答 解:(1)海水获取淡水的方法由学过的知识可知:从海水中得到淡水,主要采用的方法是蒸馏法中的多级闪急蒸馏法,渗析法、离子交换法;
故答案为:蒸馏法;渗析法(或离子交换法);
(2)从海水中得到淡水,主要采用的方法是蒸馏法,属于物理变化,海水蒸发制海盐时,只是氯化钠状态发生变化,没有新物质生成,所以海水制取食盐的过程是物理变化过程,其中提取时可以不涉及化学变化的是①③,制取的单质在常温下是液体的是溴单质,选⑥,
故答案为:①③;⑥;
(3)①把贝壳制成石灰乳,涉及的反应有分解、化合;
②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物,发生复分解反应;
③将沉淀物与盐酸反应,结晶,过滤,得到含结晶水的晶体,发生复分解反应,将得到晶体在一定条件下加热得到无水氯化镁,涉及分解反应;
④电解熔融氯化镁,得到金属镁,为分解反应.
没有涉及的反应为置换反应置换反应,
进行①②③步骤的目的是富集或浓缩MgCl2,步骤④是电解熔融的氯化镁得到金属镁和氯气,反应的化学方程式为:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,
故答案为:置换反应;富集或浓缩MgCl2;MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
点评 本题考查了海水资源的利用,物质的提取和制备过程分析判断,掌握物质性质和物质制备是解题关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 该溶液中Cl-的物质的量浓度为0.2 mol•L-1 | |
| B. | 该溶液中Ba2+的物质的量浓度为0.1 mol•L-1 | |
| C. | 可使用250 mL容量瓶分两次完成490 mL该浓度的BaCl2溶液的配制 | |
| D. | 将20.8 g BaCl2固体溶解在1 L水中,形成的溶液的浓度为0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相对分子量 | 密度/g•cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 26 | 161 | 微溶于水 |
| 环己酮 | 0.8102 | 0.8102 | -45 | 155.6 | 微溶于水 |
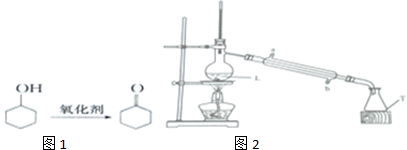
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点/℃ | 沸点/℃ | 密度/g•mL-1 | 其他 | |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3 2P+5Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 TNT是一种烈性炸药,其结构简式如图所示,它是甲苯与浓硫酸、浓硝酸在一定条件下反应生成的.下列有关TNT的说法正确的是( )
TNT是一种烈性炸药,其结构简式如图所示,它是甲苯与浓硫酸、浓硝酸在一定条件下反应生成的.下列有关TNT的说法正确的是( )| A. | TNT分子式为C7H3O6N3 | |
| B. | TNT的名称叫2,4,6-三硝基甲苯 | |
| C. | 每个TNT分子中可共平面的碳原子最多为6个 | |
| D. | 若硝酸的结构可表示为HO-NO2,每摩尔甲苯可取代3mol硝基制得TNT |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com