
| ѡ�� | ���ɣ������ʣ� | �� �� |
| A | ����Ԫ����������ϼ۵��������� | ��V��A��Ԫ��������۶���+7 |
| B | SO2��ʪ���Cl2����Ư���� | ����Ϻ�Ư���Ը�ǿ |
| C | ��ʪ��ͭ��Ũ���ᷴӦ������ȡNO2 | ����������Ũ���ᷴӦҲ������ȡNO2 |
| D | ��ǿ�������ȡ������ | CO2ͨ��NaClO��ҺҺ��������HC10 |
| A�� | A�� | B�� | B�� | C�� | C�� | D�� | D�� |
���� A����V��A��Ԫ�ط������ۣ�
B�����������������ˮ��Һ�лᷢ��������ԭ��Ӧ��
C���������Ũ���ᷢ���ۻ�����
D��̼������Աȴ����������ǿ��
��� �⣺A����V��A��Ԫ�ط������ۣ����۲���ȷ����A����
B�������ʵ����Ķ��������������ˮ��Һ�лᷢ��������ԭ��Ӧ������������ᣬ���پ���Ư���ԣ���B����
C���������Ũ���ᷢ���ۻ��������Գ���������Ũ���ᷴӦҲ������ȡNO2����C����
D��̼������Աȴ����������ǿ������CO2ͨ��NaClO��ҺҺ��������HC10����D��ȷ��
��ѡD��
���� ���⿼�������ʵ����ʷ����֪ʶ���Ѷ����У�����ʱҪע��һ���������������Ĺ�ϵ���Լ����������õ������ȣ�


 �¿α�������������ҵ�������γ�����ϵ�д�
�¿α�������������ҵ�������γ�����ϵ�д� ����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
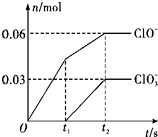 ��һ������Cl2ͨ��һ��Ũ�ȵĿ��Լ���Һ�У�����ǡ����ȫ��Ӧ����֪��Ӧ���̷��ȣ����������������ֺ���Ԫ�ص����ӣ�����ClO-��ClO3-�������ӵ����ʵ�����n���뷴Ӧʱ�䣨t���ı仯��ϵ��ͼ��ʾ������˵������ȷ���ǣ�������
��һ������Cl2ͨ��һ��Ũ�ȵĿ��Լ���Һ�У�����ǡ����ȫ��Ӧ����֪��Ӧ���̷��ȣ����������������ֺ���Ԫ�ص����ӣ�����ClO-��ClO3-�������ӵ����ʵ�����n���뷴Ӧʱ�䣨t���ı仯��ϵ��ͼ��ʾ������˵������ȷ���ǣ�������| A�� | Cl2�Ϳ��Լ���Һ�ڲ�ͬ�¶��¿��ܷ�����ͬ��Ӧ | |
| B�� | ��Ӧ��ת�Ƶ�����Ϊ��0.42 NA | |
| C�� | ԭ���Լ���Һ��KOH�����ʵ���Ϊ0.3 mol | |
| D�� | ��������Cl-�����ʵ���Ϊ0.21 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ۢܢ� | B�� | �٢ڢ� | C�� | �ڢ� | D�� | �٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ���ʹ��Na2CO3����Һ�У�2c��Na+��=c��CO32-��+c��HCO3-��+c��H2CO3�� | |
| B�� | 1mol/L�ģ�NH4��2SO4��Һ�У�c��NH4+����c��SO42-����c��H+����c��OH-�� | |
| C�� | 0.10mol/L��������Һ�У�c��Na+��+c��H+��=c��CH3COO-��+c��OH-�� | |
| D�� | �������pH=3������ʹ����к��������Ƶ����ʵ�����ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
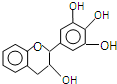 ���豶���������к��в��ӣ�����ûʳ�Ӷ����أ�EGC���Ľṹ��ͼ��ʾ������EGC��������������ȷ���ǣ�������
���豶���������к��в��ӣ�����ûʳ�Ӷ����أ�EGC���Ľṹ��ͼ��ʾ������EGC��������������ȷ���ǣ�������| A�� | ���л���ķ���ʽ��C15H13O5 | |
| B�� | 1mol EGC��4molNa�����������Ϊ44.8L | |
| C�� | ����������Ӧ��ȡ����Ӧ���ѷ����ӳɷ�Ӧ | |
| D�� | ���������е�ԭ�ӹ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | B2A2��B2A���������ӵĸ�������ͬ | |
| B�� | ԭ�Ӱ뾶�Ĵ�С˳��r��D����r��C����r��B����r��A�� | |
| C�� | D�ļ���̬�⻯������ȶ��Ա�A��ǿ | |
| D�� | Ԫ��C�ĵ�����һ�ָ�Ӳ�ȡ����۵�Ľ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
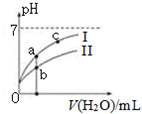 ��֪���±�Ϊ25��ʱijЩ����ĵ���ƽ�ⳣ����
��֪���±�Ϊ25��ʱijЩ����ĵ���ƽ�ⳣ����| CH3COOH | HClO | H2CO3 |
| Ka=1.8��10-5 | Ka=3.0��10-8 | Ka1=4.4��10-7Ka2=4.7��10-11 |
| A�� | ��ͬŨ�ȵ�CH3COONa��NaClO�Ļ����Һ�У�������Ũ�ȵĴ�С��ϵ�ǣ�c��Na+����c��ClO-����c��CH3COO-����c��OH-����c��H+�� | |
| B�� | ��NaClO��Һ��ͨ������������̼�����ӷ���ʽΪ��ClO-+CO2+H2O=HClO+CO32- | |
| C�� | ͼ����a��c���㴦����Һ��$\frac{c��{R}^{-}��}{c��HR��•c��O{H}^{-}��}$��ȣ�HR����CH3COOH��HClO�� | |
| D�� | ͼ����a�������Ũ�ȴ���b�������Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
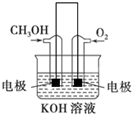 �״���һ����Ҫ�Ļ���ԭ�ϣ�
�״���һ����Ҫ�Ļ���ԭ�ϣ�| CO2%-CO%-H2% ����������� | 0-30-70 | 2-28-70 | 4-26-70 | 8-22-70 | ||||||||
| ��Ӧ�¶�/�� | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 |
| ����CH3OH��̼ת���ʣ�%�� | 4.9 | 8.8 | 11.0 | 36.5 | 50.7 | 68.3 | 19.0 | 33.1 | 56.5 | 17.7 | 33.4 | 54.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C3H7Cl | B�� | C3H6Cl2 | C�� | C3H5Cl3 | D�� | C3HCl7 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com