
 .
.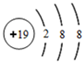 .
. 分析 (1)最外层电子数是次外层电子数4倍的二价阴离子为O2-;根据其质子数和电子数画出原子结构示意图;
(2)电子总数为18的一价简单阳离子为K+,根据其质子数和电子数画出原子结构示意图.
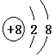
解答 解:(1)最外层电子数是次外层电子数4倍的二价阴离子,最外层最多含有8个电子,则该离子含有2个电子层,最外层含有8个离子,应该为O2-,氧离子的核电荷数为8,核外电子总数为10,最外层达到8电子稳定结构,其离子结构示意图为: ,
,
故答案为:O2-, ;
;
(2)电子总数为18的一价简单阳离子为K+,其质子数为19,核外电子数为18,则离子结构示意图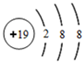 ,
,
故答案为:K+,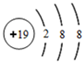 .
.
点评 本题考查原子核外电子排布,题目难度不大,解此题的关键是要熟练掌握原(离)子符号的书写及粒子结构示意图的画法.要弄清题目要求画的究竟是原子结构示意图还是离子结构示意图,是阳离子结构示意图还是阴离子结构示意图,再结合原子核外电子排布规律画出符合题目要求的原(离)子结构示意图.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:实验题
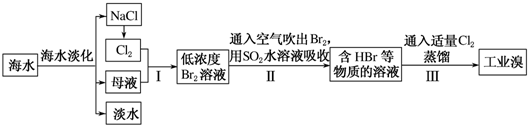
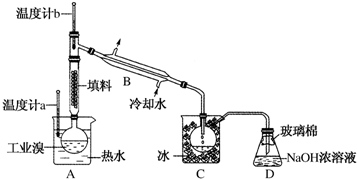
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的比例模型: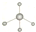 | B. | 苯的最简式:CH | ||
| C. | 乙烯的分子式:CH2=CH2 | D. | 乙醇的结构简式:C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
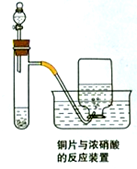 如图为铜片与浓硝酸反应的装置示意图,据图回答下列问题:
如图为铜片与浓硝酸反应的装置示意图,据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com