
 (2)乙炔的结构式H-C≡C-H
(2)乙炔的结构式H-C≡C-H分析 (1)甲基中含有3个碳氢键,碳原子最外层为7个电子,据此写出甲基的电子式;
(2)乙炔分子中含有一个C≡C;
(3)设烷烃的分子式为CxH(2x+2),根据相对分子质量为72,列出方程式进行计算x值,支链越多,沸点越低;
(4)①燃烧热是1mo可燃物完全燃烧生成稳定氧化物放出的热量,根据盖斯定律及已知热化学方程式得出氢气燃烧热的热化学方程式;
②依据盖斯定律和热化学方程式计算得到;
③根据化学处于平衡时正逆反应速率相等,各组成成分不变,以及有关物理量与平衡移动的关系作判断;
(5)增大物质的浓度、升高温度、使用催化剂、增大气体的压强等均可增大反应速率.
解答 解:(1)甲基中碳原子最外层为7个电子,甲基的电子式为: ,故答案为:
,故答案为: ;
;
(2)乙炔分子中含有一个C≡C,乙炔的结构式H-C≡C-H;故答案为:H-C≡C-H;
(3)设烷烃的分子式为CxH(2x+2),
则14x+2=72,解得x=5,
所以该烷烃的分子式为C5H12,
分子式为C5H12的同分异构体有主链有5个碳原子的:CH3CH2CH2CH2CH3,
主链有4个碳原子的:CH3CH(CH3)CH2CH3,
主链有3个碳原子的:CH3C(CH3)2CH3;
支链越多,沸点越低,故C(CH3)4,
故答案为:C(CH3)4;
(4)①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1①
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1②,
根据盖斯定律①×$\frac{1}{2}$+②可得:氢气的燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O (l)△H=-285.8kJ/mol,
所以氢气的燃烧热为:△H═-285.8KJ/mol,
故答案为:285.8;
②CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol②,
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol②,
根据盖斯定律②×2-①得到:CH3OH(g)+O2(g)?CO(g)+2H2O(g)△H=-392.8 kJ/mol,
故答案为:-392.8 kJ/mol;
③A.CO百分含量保持不变,说明CO的浓度保持不变,说明处于平衡状态,故A正确;
B.容器中H2浓度与CO浓度相等,并不能代表物质的量不再发生变化,因此不能作为平衡的标志,故B错误;
C.容器的体积不变,气体的质量守恒,所以密度始终不变,因此不能作为平衡的标志,故C错误,
D.CO的生成速率为逆速率,CH3OH的生成速率为正速率,二者相等,说明正逆反应速率相等,说明处于平衡状态,故D正确,
故选AD;
(5)①增加C的物质的量,C为固体,其浓度不变,所以反应速率不变,故错误;
②升高反应温度,反应速率增大,故正确;
③随时吸收CO、H2转化为CH3OH,反应物的浓度减小,则反应速率减小,故错误;
④密闭定容容器中充入CO(g),CO的浓度增大,则反应速率增大,故正确;
故答案为:②④.
点评 本题考查了反应热的计算、盖斯定律的应用、电子式、化学平衡状态的判断、影响反应速率的因素等,题目难度中等,注意掌握热化学方程式的书写原则,明确盖斯定律在反应热计算中的应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
| 实验步骤 | 操作 | 现象与结论 | 离子方程式 |
| 第一步 | 取少量溶液装于试管,向试管中加入几滴KSCN溶液 | ||
| 第二步 | 若溶液紫色褪去,则溶液含有Fe2+;若无明显变化,则不含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | B. | c(Na+)+c(H+)═c(S2-)+c(HS-)+c(OH-) | ||
| C. | c(Na+)═c(HS-)+2c(H2S)+2c(S2-) | D. | c(OH-)═c(H+)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
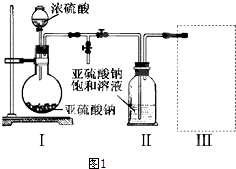
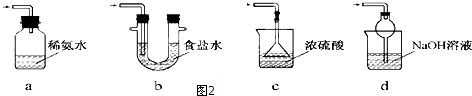

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 氧化性:Cl2>S | C. | 稳定性:HBr>HI | D. | 酸性:H3PO4>HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com