
下列各组化合物中,化学键类型都相同的是( )
A.NH4Cl和Na2S B.Na2O和Na2O2
C.CO2和CS2 D.HCl和NaOH
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使甲基橙变红色的溶液:Mg2+、K+、SO 、NO
、NO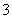
B.使酚酞变红色的溶液:Na+、Cu2+、HCO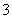 、NO
、NO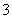
C.0.1 mol·L-1 AgNO3溶液:H+、K+、SO 、I-
、I-
D.0.1 mol·L-1 NaAlO2溶液:H+、Na+、Cl-、SO
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是( )
A.①线表示Al3+的物质的量的变化
B.x表示AlCl3的物质的量
C.③线表示Al(OH)3的物质的量的变化
D.④线表示AlO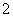 的物质的量的变化
的物质的量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质时,消耗碱量最多的是( )
A.Al B.Al(OH)3
C.AlCl3 D.Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
将镁、铝的混合物共0.2 mol, 溶于200 mL 4 mol·L-1的盐酸溶液中,然后再滴加2 mol·L-1的NaOH溶液。请回答下列问题:
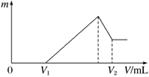
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。当V1=160 mL时,则金属粉末中n(Al)=________ mol。
(2)0~V1段发生的反应的离子方程式为__________。
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________ mL。
(4)若镁、铝的混合物仍为0.2 mol,其中镁粉的物质的量分数为a,改用200 mL 4 mol·L-1的硫酸溶解此混合物后,再加入840 mL 2 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3,则a的取值范围为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下叙述中,错误的是( )
A.钠原子和氯原子作用生成NaCl后,其结构的稳定性增强
B.在氯化钠中,除氯离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用
C.任何离子键在形成的过程中必定有电子的得与失
D.金属钠与氯气反应生成氯化钠后,体系能量降低
查看答案和解析>>
科目:高中化学 来源: 题型:
我国已经成功研制出了碱金属的球碳盐K3C60。实验测知该物质在熔融状态下可以导电,而且在超临界温度18 K时具有超导性。
(1)K3C60含有化学键的类型为__________________(填“极性键”、“非极性键”或“离子键”)。
(2)1 mol K3C60含有的离子数目为________。
(3)K3C60中的C60俗称足球烯,分子结构酷似足球,由12个正五边形与20个正六边形构成,碳碳键长介于碳碳单键与碳碳双键之间,则其中碳的杂化方式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下,向20 mL 0.01 mol·L-1 CH3COOH溶液中逐滴加入0.01 mol·L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
(1)a点溶液中c(H+)为________,pH约为________。
(2)a、b、c、d四点中水的电离程度最大的是__________,滴定过程中宜选用____________作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
(3)若向20 mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。
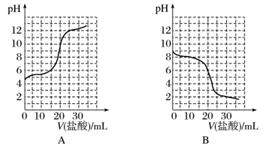
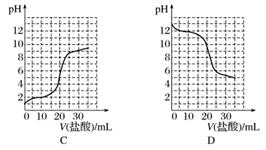
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com