
����Ŀ��ij�¶��£������ݻ���Ϊ2.0 L�����ܱ������з�����Ӧ2NO(g)��2CO(g)![]() N2(g)��2CO2(g)������������ʼ���ʵ���Ũ���뷴Ӧ�¶����±���ʾ��
N2(g)��2CO2(g)������������ʼ���ʵ���Ũ���뷴Ӧ�¶����±���ʾ��
���� | �¶�/�� | ��ʼ���ʵ���Ũ��/(mol��L��1) | |||
NO(g) | CO(g) | N2 | CO2 | ||
�� | T1 | 0.10 | 0.10 | 0 | 0 |
�� | T2 | 0 | 0 | 0.10 | 0.20 |
�� | T2 | 0.10 | 0.10 | 0 | 0 |
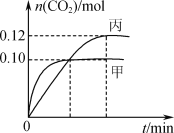
��Ӧ�����мס���������CO2�����ʵ������仯��ϵ��ͼ��ʾ������˵����ȷ����
A.�÷�Ӧ������ӦΪ���ȷ�Ӧ��ƽ�ⳣ��K(T1)<K(T2)
B.�ﵽƽ��ʱ���������е�ѹǿһ�����ڼ�������2��
C.�������з�Ӧ�ﵽƽ��ʱ��N2��ת���ʴ���40%
D.�������з�Ӧ�ﵽƽ����ٳ���0.10 mol NO��0.10 mol CO2����ʱv(��)>v(��)
���𰸡�AD
��������
A���ȹ���ƽ�¶ȸߣ���ƽ��״̬������̼���ʵ���С��˵���¶�Խ��ƽ��������У��淴ӦΪ���ȷ�Ӧ������ӦΪ���ȷ�Ӧ���¶�T1��T2��ƽ�ⳣ��K(T1)<K(T2)����A��ȷ��
B���¶�T1��T2����ӦΪ���ȷ�Ӧ���¶�Խ��ƽ��������У��������ʵ�����С������ѹǿ��С�����������ʵ���Ϊ��һ�����൱������ѹǿ��ƽ��������У��������ʵ�����С���ﵽƽ��ʱ���������е�ѹǿһ��С�ڼ�������2������B����
C����ͼ��֪�����дﵽƽ��״̬������̼0.12mol��
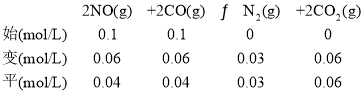
�����ﵽ��ͬƽ��״̬���������һ����Ũ�ȱ�Ϊԭ���Ķ���֮һ��
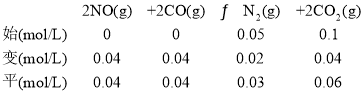
��ʱ����ת����![]() ������ͬ��������£��൱�������Сѹǿ����ƽ��������У�����ת����С��40%����C����
������ͬ��������£��൱�������Сѹǿ����ƽ��������У�����ת����С��40%����C����
D����ϱ����б���������ݣ���������ʽ����
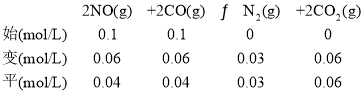
ƽ�ⳣ��![]() ���������з�Ӧ�ﵽƽ����ٳ�0.10 mol NO��0.10 mol CO2��Ũ����Qc=
���������з�Ӧ�ﵽƽ����ٳ�0.10 mol NO��0.10 mol CO2��Ũ����Qc=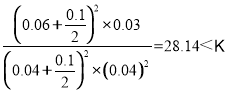 ��ƽ��������У���ʱv(��)��v(��)����D��ȷ��
��ƽ��������У���ʱv(��)��v(��)����D��ȷ��
��ѡAD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ݻ�Ϊ2L�ĺ��º����ܱ������г���2mol SO2��1mol O2��������Ӧ2SO2(g)+O2(g) ![]() 2SO3(g) ��H=-Q kJ��mol-l (Q>O)�������й�˵������ȷ����
2SO3(g) ��H=-Q kJ��mol-l (Q>O)�������й�˵������ȷ����
A. ��Ӧ�ﵽƽ��ʱ���ų�����ΪQkJ
B. ��������ѹǿ���ٷ�����������Ӧ�ﵽƽ��
C. ��Ӧ������c(SO2)+ c(SO3)=1 mol��L-1�����
D. ƽ��ʱ��SO2��O2��ת�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ijһ�ݻ�Ϊ5 L���ܱ������У��������»�ѧ��Ӧ�� CO2��g����H2��g��![]() CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
T /�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK ��______________��
��2���÷�ӦΪ____________��Ӧ��������������������������
��3�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬��������________________��
a ������ѹǿ���� b ��������� c��CO������
c ������H2����������H2O�� d c ��CO2����c ��CO��
��4��830���£������ʵ�Ũ�ȹ�ϵ��c ��CO2����c ��H2�� > c ��CO����c ��H2O�������ʱ����Ӧ�������淴Ӧ���ʵĹ�ϵ��____________��
a ���� > ���� b ���� �� ���� c ���� < ���� d ���ж�
��5������ʼʱ��������м���CO2��H2��0.1 mol����830��ʹ������ڵ������£���Ӧ�ﵽƽ��ʱ��ˮ���������ʵ���Ũ��c��H2O����_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ĺϳɶԹ��ҹ�ҵ��չ���ž������ص����ã�����ݻ�ѧԭ��֪ʶ�ش��������⣺
��1����֪������ȼ����Ϊ285.8kJ/mol��
4NH3 (g) +5O2 (g) ![]() 4NO(g) + 6H2O(l) ��H= ��1168.8kJ/mol
4NO(g) + 6H2O(l) ��H= ��1168.8kJ/mol
N2��g��+ O2��g���T 2NO��g����H = +180.6kJ/mol��
��ҵ�ϳɰ����Ȼ�ѧ����ʽΪ________________��
��2��ij����С���о����������������������£��ı���ʼ�����������ʵ�����N2(g)+3H2(g) 2NH3(g)��Ӧ��Ӱ�졣ʵ������ͼ��ʾ����ͼ�� T��ʾ�¶ȣ� n��ʾ���ʵ�����
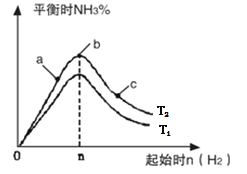
��ͼ���� T2�� T1�Ĺ�ϵ�ǣ� T2 _______________ T1������ڡ��������ڡ��� �����ڡ�����ȷ��������
�ڱȽ���a��b��c����������ƽ��״̬�У���Ӧ��N 2 ��ת������ߵ���_______________������ĸ����
������ʼ��ϵ��n(N2)��n(H2)= 1:3ʱ����Ӧ�İٷֺ�������������ݻ�Ϊ1L�� n=3mol��Ӧ�ﵽƽ��ʱH2��ת����Ϊ60%����������£� T 2������Ӧ��ƽ�ⳣ�� K=__________________��
��3����Ԫ�ص�+4�������������֣�����֮�䷢����Ӧ��2NO2![]() N2O4 H < 0����һ������NO2����ע�����к��ڣ���ͼ���������ѹ��ע�����Ĺ���������������ʱ��ı仯 (������ɫԽ�����ԽС)������˵����ȷ����______________
N2O4 H < 0����һ������NO2����ע�����к��ڣ���ͼ���������ѹ��ע�����Ĺ���������������ʱ��ı仯 (������ɫԽ�����ԽС)������˵����ȷ����______________

A��b��IJ�����ѹ��ע����
B��c����a����ȣ� c(NO2)���� c(N2O4)��С
C������������ϵ�¶ȱ仯����û��������ʧ����b��c�����ƽ�ⳣ��Kb>Kc
D��d�㣺v(��)> v(��)
��4�����÷�Ӧ6NO2+8NH3=7N2+12H2O����ԭ��أ�����������������ŷţ����ỷ����Ⱦ��װ����ͼ��ʾ��
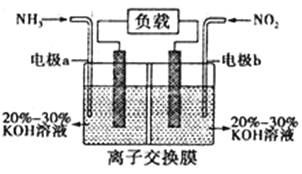
�ٵ缫aΪ___________________������缫��ӦʽΪ__________________��
�ڵ���0.1 mol NO2������ʱ��ת�Ƶ���Ϊ________________mol��
��Ϊʹ��س����ŵ磬�����ӽ���Ĥ��ѡ��___________________����Ĥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼���̿�(��Ҫ�ɷ�MnCO3��������FeCO3��MnO2��Al2O3��SiO2��)����ȡ�����̵�һ���������£�
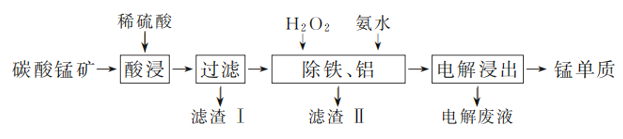
(1) ������������У������Ԫ�ؽ����ʵĴ�ʩ�У��ʵ�������Ũ�ȡ�________________(��һ��)��
(2) ���������������䣬�ڲ�ͬ�¶��¶�̼���̿�����������Ԫ�صĽ�������ʱ��仯����ͼ��ʾ�������������¶Ⱥ�ʱ��ֱ���________��
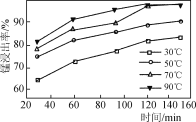 ����
����
��ȡ��������ؽ������������������������pH
�������� | Fe3�� | Fe2�� | Al3�� | Mn2�� |
��ʼ������pH | 1.8 | 5.8 | 3.0 | 7.8 |
��ȫ������pH | 3.2 | 8.8 | 5.0 | 9.8 |
(3) ��֪�����������Һ����Ԫ��ֻ��Mn2����ʽ���ڣ�����������з���������ԭ��Ӧ�����ӷ���ʽΪ________________________________________��
(4) ����ϱ���������������ʱ���백ˮ���Ʒ�ӦҺpH�ķ�ΧΪ________��
(5) �����������м����H2O2����������������Һ�л�����Ԫ�ز��࣬������Ӱ�������̵Ĵ��ȡ�����Ƽ�Ҫʵ�鷽��������֤�������Һ���Ƿ�����Ԫ�أ� _________________��
(6) ��ʯīΪ�缫���������������Һ��õ����̡�����Һ�п�ѭ�����õ�������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��������ͨ��5 ![]() ��������ͭ�缫�������������Իش�:
��������ͭ�缫�������������Իش�:
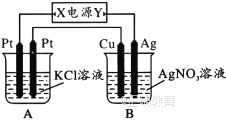
��1����Դ�缫![]() ������Ϊ________(��������������������)��
������Ϊ________(��������������������)��
��2������![]() �������ĵ缫��Ӧʽ��____________��
�������ĵ缫��Ӧʽ��____________��
��3����![]() ��Һ�������200
��Һ�������200 ![]() ����ͭ�缫����������2. 16
����ͭ�缫����������2. 16 ![]() ʱ
ʱ![]() ����Һ��
����Һ��![]() ____________ (���Ե��ǰ����Һ����ı仯)����Ҫʹ�������Һ�ָ�������ǰ��ȫ��ͬ��״̬����Ӧ����____________(�����ʵ����༰����)��
____________ (���Ե��ǰ����Һ����ı仯)����Ҫʹ�������Һ�ָ�������ǰ��ȫ��ͬ��״̬����Ӧ����____________(�����ʵ����༰����)��
��4����֪���ǰ������B��ͭ�����缫��������ȣ�ͨ��һ��ʱ���ͭ�����缫��������Ϊ2.16 ![]() ʱ������A�����ɵ��������Ϊ________
ʱ������A�����ɵ��������Ϊ________![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£�����ѡ������ʾ�����ʼ�ת������һ��ʵ�ֵ������
A.SiO2(s) ![]() SiCl4(g)
SiCl4(g) ![]() Si(s)
Si(s)
B.Fe3O4(s) ![]() Fe(s)
Fe(s) ![]() FeCl2(s)
FeCl2(s)
C.AgNO3(aq) ![]() [Ag(NH3)2]��
[Ag(NH3)2]��![]() Ag(s)
Ag(s)
D.Al2O3(s) ![]() NaAlO2(aq)
NaAlO2(aq) ![]() Al(OH)3(s)
Al(OH)3(s)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ɱ���ܱ�������ʢ��������A��B�Ļ�����壬��һ�������·�����Ӧ��![]() ����ά���¶Ⱥ�ѹǿ���䣬���ﵽƽ��ʱ�����������ΪVL������C���������Ϊ
����ά���¶Ⱥ�ѹǿ���䣬���ﵽƽ��ʱ�����������ΪVL������C���������Ϊ![]() �������ƶ�����ȷ����
�������ƶ�����ȷ����![]()
��ԭ�����������Ϊ![]()
�ڷ�Ӧǰ����A��![]()
�۷�Ӧƽ��ʱ����B���ĵ�![]()
��ƽ��ʱB���������Ϊ![]()
A.�٢�B.�٢�C.�ڢ�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A. 100g46%����(HCOOH)ˮ��Һ��������ԭ����Ϊ5NA
B. ��״����,18g��ˮ�й��ۼ�����ĿΪNA
C. 56g����71gCl2��ַ�Ӧ��ת�Ƶ�����ĿΪ3NA
D. 7.8gNa2O2��������ˮ(H218O)��Ӧ���ɵ�����������������Ϊ0.5NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com