
| 操作及现象 | 结论 | |
| A | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | Br-还原性强于Cl- |
| D | 向溶液X的稀溶液中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 溶液X中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.同类型的沉淀转化时,溶度积大的沉淀转化为溶度积小的沉淀;
B.原溶液中含有Fe3+,加入KSCN溶液,溶液呈红色;
C.向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色,说明有Br2生成,发生反应:2Br-+Cl2=2Cl-+Br2,还原剂还原性强于还原产物还原性;
D.氨气极易溶于水,氢氧化钠和X的溶液都是稀溶液,反应中不会生成氨气.
解答 解:A.同类型的沉淀转化时,难溶电解质之间可实现由溶度积常数较大的物质转化为溶度积常数较小的物质,AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI),故A错误;
B.原溶液中若含有Fe3+,加入KSCN溶液,溶液也会呈红色,不能说明原溶液中是否含有Fe2+,故B错误;
C.向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色,说明有Br2生成,发生反应:2Br-+Cl2=2Cl-+Br2,说明Br-还原性强于Cl-,故C正确;
D.向溶液X的稀溶液中滴加NaOH稀溶液,由于氨气极易溶于水,且没有加热,则该方法无法检验铵根离子,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握沉淀的转化、离子检验、物质的性质、现象与结论的关系、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:推断题
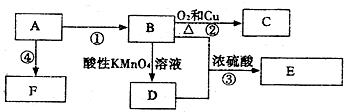
 ,C的名称乙醛,
,C的名称乙醛,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L水中含有1 mol NaCl | |
| B. | 溶液中含有1 mol NaCl | |
| C. | 1 L溶液中含有1 molNaCl | |
| D. | 将58.5 g NaCl溶于1 L水中所得的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
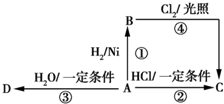 某烃A是有机化学工业的基础原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.
某烃A是有机化学工业的基础原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 至少存在4种离子 | |
| B. | Cl-一定存在,且c(Cl )≥0.4 mol/L | |
| C. | SO42-、NH4+,一定存在,Cl-可能不存在 | |
| D. | CO32-、Al3+一定不存在,K+可能存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com