
(12分)我国濒临海域的省份,能够充分利用海水制得多种化工产品。如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中固体B是生活中的一种必需品,E是一种化肥,N是一种常见的金属单质。
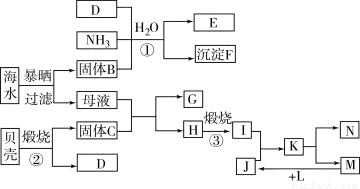
结合上述工艺流程回答下列问题。
(1)物质H和L的化学式分别为 和 。
(2)上述工艺流程中可以循环使用的物质的化学式为____________。
(3)反应①的化学方程式为 ;在反应①中必须先通入NH3,而后通入D,其原因是 。
(4)工业上利用F可制得另一种化工产品,该反应的化学方程式为 。
(5)由K溶液经如何处理才能制得N?工业上将K溶液在 的条件蒸发结晶制得无水盐,然后再电解其熔融盐,写出电解的化学反应方程式 。
(1)Mg(OH)2 H2 (2)CO2(各1分)
(3)NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl(2分)
NH3在水中的溶解度大,先通入NH3,有利于吸收CO2(2分)
 (2分)
(2分)
(5)在氯化氢气流中 (1分) MgCl2 ====Mg + Cl2↑(2分)
【解析】
试题分析:(1)根据题给转化关系知,物质H和L的化学式分别为Mg(OH)2和H2;(2)上述工艺流程中可以循环使用的物质的化学式为CO2。(3)反应①为氨气、氯化钠、二氧化碳和水反应生成碳酸氢钠,化学方程式为NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl;在反应①中必须先通入NH3,而后通入D,其原因是NH3在水中的溶解度大,先通入NH3,有利于吸收CO2。(4)工业上利用碳酸氢钠可制得另一种化工产品碳酸钠,该反应的化学方程式为2NaHCO3 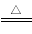 Na2CO3 + CO2↑+ H2O。(5)为防止氯化镁水解,工业上将氯化镁溶液在在氯化氢气流中蒸发结晶制得无水盐,然后再电解其熔融盐,电解的化学反应方程式MgCl2
Na2CO3 + CO2↑+ H2O。(5)为防止氯化镁水解,工业上将氯化镁溶液在在氯化氢气流中蒸发结晶制得无水盐,然后再电解其熔融盐,电解的化学反应方程式MgCl2  Mg + Cl2↑。
Mg + Cl2↑。
考点:考查无机推断、海水的综合利用。


科目:高中化学 来源:2013-2014北京市东城区高三二模理综化学试卷(解析版) 题型:简答题
(14分)硒(34Se)和碲(52Te)都是第VIA族元素,硒是分布在地壳中的稀有元素。工业上硒鼓废料(主要成分硒、碲、碳、铜和铁合金)回收精炼硒的流程如下:
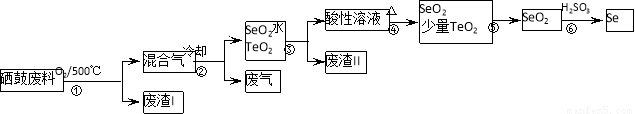
已知:
物理性质 | 熔点 | 沸点 | 升华 | 溶解性 |
SeO2 | 340℃ | 684℃ | 315℃ | 易溶于水 |
TeO2 | 733℃ | 1260℃ | 450℃ | 微溶于水 |
(1)Se的氢化物的电子式是______。
(2)步骤①中通入的氧气使硒鼓废料翻腾,目的是______。
(3)废气的主要成分是______;废渣II的主要成分是______。
(4)步骤④中主要反应的化学方程式是______;步骤⑥反应的化学方程式是______。
(5)根据表中数据,步骤⑤最适宜的分离方法是______。
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古赤峰市高三下学期4月统一考试理综化学试卷(解析版) 题型:选择题
设NA代表阿伏伽德罗常数的述职,下列说法中正确的是( )
A.在标准状况下,33.6LSO3中含有的氧原子数是4.5NA
B。两份均为2.7g的铝样品分别为100mL浓度均为2mol·L-1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3 NA
C.常温常压下,agC2H4和C3H6的混合气体中所含共用电子对数目为3a/14·NA
D.6.0g金刚石中含有的共价键数为2 NA
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省红河州高三下学期毕业生复习统一检测理综化学试卷(解析版) 题型:填空题
(14分)2013年12月2日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥三号”探月卫星成功送入太空,进一步向广寒宫探索。“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:①N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1
② H2(g)+
H2(g)+  F2(g) = HF(g) △H = -269kJ·mol-1
F2(g) = HF(g) △H = -269kJ·mol-1
③H2(g)+  O2(g) = H2O(g) △H = -242kJ·mol-1
O2(g) = H2O(g) △H = -242kJ·mol-1
请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g)  2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
n(O2)(mol) | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(1)已知:K800℃>K1000℃,则该反应的ΔH ______0(填“大于”或“小于”),用O2表示从0~2 s内该反应的平均速率为__________。
(2)能说明该反应已达到平衡状态的是________。
A.容器内颜色保持不变 B. 2v逆(NO)=v正(O2)
C.容器内压强保持不变 D.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有 。
(4)在上述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=______________。
(5)在上述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,则NO2的转化率为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省红河州高三下学期毕业生复习统一检测理综化学试卷(解析版) 题型:选择题
如图是立方烷的球棍模型, 下列有关说法不正确的是
下列有关说法不正确的是
A.其一氯代物只有一种同分异构体
B.其二氯代物有三种同分异构体
C.它的分子式不符合CnH2n+2,所以它不是饱和烃
D.它与苯乙烯(C6H5—CH=CH2)互为同分异构体
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C.常温下,向10mL PH=3的醋酸溶液中加水稀释后,溶液中C(CH3COO--)/C(CH3COOH) C(OH--)的值减小
D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH)/c(NH3·H2O)的值增大
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:选择题
某金属元素R的硝酸盐R(NO3)n溶液用Pt电极电解,阳极产生气体V L(标准状况)时,阴极质量增加m g,若R的原子量为M,下列叙述中不正确的是 ( )
A.电路中通过电子 mol B.n=
mol B.n=
C.溶液中H+增加 mol D.n=
mol D.n=
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高三5月校统测理科综合化学试卷(解析版) 题型:实验题
(15分)Ⅰ.某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):

(1)请结合化学平衡移动原理解释B中溶液的作用 。
(2)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤,取一定量配成样液,并加入BaCl2溶液,出现白色沉淀并有气体产生,其离子方程是 。
Ⅱ.某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器b中可选择的试剂为(任意填一种)_____________。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为_______________。
(3)F中读取气体体积前,应向上或向下移动右管,使得左右两边液面相平,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积________ (填“偏大”或“偏小”或“无影响”)。
(4)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据________(填序号)。
a.B装置实验前后质量差mg; b.F装置实验前后液面差VL
c.D装置实验前后质量差mg; d.E装置实验前后质量差mg;
(5)E装置中浓硫酸的作用是__________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省昭通市毕业生复习统一检测理科综合化学试卷(解析版) 题型:填空题
(15分)硝酸铵在现代农业生产和国防中都占有重要地位,下图是云南天然气化工厂合成硝酸铵的简要生产工艺流程:

回答下列问题:
(1)N2的电子式 ,合成氨的反应中,若生成1g氨放出热量a KJ,写出该反应的热化学方程式 。
(2)氨催化氧化的化学方程式是 ,
试从化学反应速率和化学平衡原理分析温度、压强对合成氨反应的影响 。
(3)若输送NH3的管道某处发生泄漏,检测的简单方法 。
(4)农业生产上长期、过量使用化肥硝酸铵,会加重土壤酸化,原因是(用离子方程式回答) 。
(5)25℃时,将x mol NH4NO3溶于一定量水中,向该溶液中滴加y L氨水后溶液呈中性,则滴加氨水过程中水的电离平衡将 (填“正向” “不”或“逆向”)移动,所滴加氨水的物质的量浓度为 (25℃时,Kb(NH3·H2O)=2.0 × 10-5 mol·L-1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com