
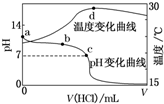
 室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14 mol•L-1 | |
| B. | b点:c(NH${\;}_{4}^{+}$)+c(NH3•H2O)=c(Cl-) | |
| C. | c点:c(Cl-)=c(NH${\;}_{4}^{+}$) | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
分析 根据酸碱滴定过程的图中a、b、c点的pH值来分析溶液中离子的浓度或溶液中的溶质,并利用原子守恒和电荷守恒来分析解答.
解答 解:A、因a点7<pH<14,因此水电离出的c(H+)>1.0×10-14mol•L-1,故A错误;
B、b点时pH>7,则盐酸和氨水反应,氨水过量,则c(NH4+)+c(NH3•H2O)>c(Cl-),故B错误;
C、因c点pH=7,不是常温,溶液呈碱性,则c(H+)<c(OH-),根据电荷守恒可知c(Cl-)<c(NH4+),故C错误;
D、d点时盐酸和氨水恰好完全反应,放热最多,再加盐酸温度降低只能是加入盐酸的温度低于溶液温度,这才是温度下降的原因,故D错误;
故选:D.
点评 本题考查水溶液中的电离平衡以及酸碱中和滴定,明确滴定曲线中各点的pH是解答的关键,并学会利用物料守恒、电荷守恒来解答此类习题.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某科研小组研究在其他条件不变的情况下,改变起始氢气的物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
某科研小组研究在其他条件不变的情况下,改变起始氢气的物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌跟稀硫酸反应:Zn+2H+=Zn2++H2↑ | |
| B. | 用氯化铁溶液腐蚀铜箔制造印刷电路板:Fe3++Cu=Fe2++Cu2+ | |
| C. | 碳酸钙中加入稀盐酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 单质氯气与水的反应:Cl2+H2O=H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com