
【题目】除去下列物质中的杂质( )![]() 括号内为杂质
括号内为杂质![]() ,所选用的试剂及操作方法均正确的一组是( )
,所选用的试剂及操作方法均正确的一组是( )
选项 | 待提纯的物质 | 选用的试剂 | 操作的方法 |
A |
| 水 | 溶解、过滤、结晶 |
B |
| 稀盐酸 | 溶解、过滤、洗涤、干燥 |
C |
| 氢氧化钠溶液 | 过滤 |
D |
| 氧气 | 点燃 |
A.AB.BC.CD.D
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】转鼓指数是反映烧结矿的机械强度的物理性能指标,其值越大,机械强度越好。某炼钢厂的工业废渣中主要含有Al2O3、Fe2O3、SiO2,对该废渣进行处理来获取活性氧化铝,其流程如下:
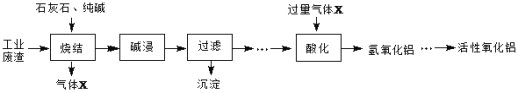
(1)烧结产物主要有NaAlO2、CaSiO3、NaFeO2及气体X。气体X是_________。
(2)烧结产物NaAlO2也可以通过所学知识由Al2O3转化得到,写出反应的离子方程式____
(3)写出由氢氧化铝制备氧化铝的化学方程式:____________________。
(4)碱浸前需将烧结产物进行粉碎,其目的是_________。碱浸过程中,NaFeO2可与水应生成NaOH和一种含铁的化合物,写出该反应的化学方程式_________________。
(5)某同学设计了由废渣(Al2O3、Fe2O3)制备纯净的Al2(SO4)3·18H2O晶体的实验步骤。请利用所学和流程中的信息补充完整:向一定量滤渣中加入足量的稀硫酸,充分反应,无不溶物后,滴加NaOH溶液至生成的沉淀不再减少,过滤,__________,将所得溶液蒸发浓缩,冷却结晶,过滤,抽干,装瓶。(实验中必须使用的试剂:CO2气体、稀硫酸、蒸馏水)
(6)已知试剂EDTA分别能与Al3+或Pb2+以物质的量之比1︰1进行反应。现测定硫酸铝晶体样品中Al2(SO4)3·18H2O(摩尔质量为666g/mol)质量分数的实验步骤如下:(杂质不与EDTA反应)
步骤1:准确称取硫酸铝晶体样品m g,溶于25 mL水中。
步骤2:加入c1 mo1·L-1EDTA溶液V1mL(过量),煮沸、冷却。
步骤3:再向上述溶液中加入c2 mol·L- 1Pb(NO3)2 溶液V2mL 恰好与过量的EDTA溶液完全反应。
请根据上述数据计算该样品中Al2(SO4)3·18H2O的质量分数。(用含字母的代数式表示)。__________(写出具体计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中为实验室制取氯气及性质验证的装置图:
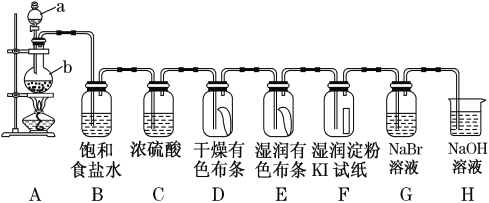
参考装置图回答下列问题:
(1)请指出仪器a的名称____________________,写出装置A中反应的化学方程式____________
(2)在装置D中可观察到的现象是________,装置E中可观察到的现象是__________。
(3)装置B的作用为_____,装置C的作用为____________,装置H的作用为_________,写出装置H中的离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示。下列分析错误的是( )

A. AB段的反应为Fe+2Fe3+===3Fe2+
B. 第二份溶液中最终溶质为FeSO4
C. 混合酸中NO![]() 物质的量为0.4 mol
物质的量为0.4 mol
D. 混合酸中H2SO4浓度为5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应xH2S(g)![]() xH2(g)+Sx(g)(x>1)达到平衡后,下列说法错误的是( )
xH2(g)+Sx(g)(x>1)达到平衡后,下列说法错误的是( )
A.若恒容充入H2,则新平衡后H2S分解率下降
B.若增大压强,气体颜色变深,则Sx为有色气体
C.若恒容升温后,气体密度不变,说明达到了新平衡
D.若改变某一条件后,压强不能作为判断新平衡的标志,则Sx状态发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,m g气体A与n g气体B的分子数目一样多,下列说法不正确的是( )
A. 在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m∶n
B. 25 ℃、1.25×105 Pa时,两气体的密度之比为n∶m
C. 同质量的A、B在非标准状况下,其分子数之比为n∶m
D. 相同状况下,同体积的气体A与B的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界存在丰富的碳、氮、氧、铝、钾、铁、碘等元素,按要求回答下列问题:
(1)常温,羰基铁[Fe(CO)x)]是红棕色液体,不溶于水,溶于乙醇、乙醚等,据此判断羰基铁晶体属于________________(填晶体类型),羰基铁的配体是________。已知:羰基铁的中心原子价电子数与配体提供电子数之和为18,则x=_________;98g羰基铁中含有的![]() 键数为______________个。
键数为______________个。
(2)亚铁离子具有强还原性,从电子排布的角度解释,其原因是__________
(3)BN晶体、AlN晶体结构相似,如图1,两者熔沸点较高的物质是______,原因是_________
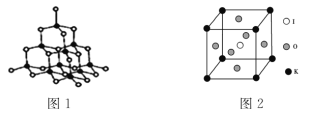
(4)KIO3晶体是一种性能良好的光学材料,其晶胞为立方体,晶胞中K、I、O分别处于顶点、体心、面心位置,如图2所示,如果KIO3密度为a g![]() cm-3,则K与O间的最短距离为___cm。
cm-3,则K与O间的最短距离为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种典型的强氧化剂。
完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO+Cu2S+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO+CuS+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是______(填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为85
c.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
Ⅱ.在稀硫酸中,MnO和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO+5e-+8H+===Mn2++4H2O
(2)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为________。
(3)已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被1 mol KMnO4氧化的H2O2是______mol。
Ⅲ.高锰酸钾溶液与硫化亚铁有如下反应:10FeS+6KMnO4+24H2SO4===3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O
(4)若上述反应前后固体的质量减少了2.8 g,则硫元素与KMnO4之间发生电子转移的数目为________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为______________________。
(2)A中的碳原子是否都处于同一平面?________(填“是”或“不是”)。
(3)A能发生如下转化,其中D1、D2互为同分异构体,E1、E2互为同分异构体。

反应②的化学方程式为_______________,C的化学名称是__________;E2的结构简式是______________,④、⑥的反应类型依次是______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com