
| A、途径Ⅰ与途径Ⅱ所得混合气体的百分组成相同 |
| B、途径Ⅰ的反应速率v(N2)与途径Ⅱ的反应速率v(NH3)的比值为1:2 |
| C、途径Ⅰ所得NH3的浓度与途径Ⅱ所得NH3的浓度之比为1:2 |
| D、途径Ⅰ与途径Ⅱ所得平衡混合气体的物质的量之比为1:2 |


科目:高中化学 来源: 题型:
| A、检验溶液中是否含有SO32-时,用HNO3酸化后再加BaCl2溶液 |
| B、为提高KMnO4溶液的氧化能力,用盐酸酸化KMnO4溶液 |
| C、检验某溶液是否含有Fe3+时,用HNO3酸化后,加KSCN溶液 |
| D、检验溶液中是否含有SO42-时,用HCl酸化后,加BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
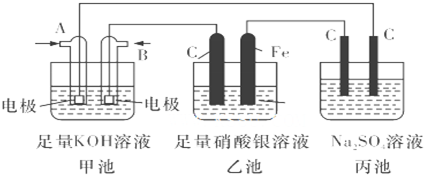
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2(g)的消耗速率与I2(g)的生成速率始终相等 |
| B、反应过程中,H2(g)和I2(g)的转化率始终相等 |
| C、平衡前,正、逆反应速率的比值恒定 |
| D、反应开始至2min末,v(H2)=0.3mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系 能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
| A、Q1=Q2=Q3=197kJ |
| B、若在上述条件下反应生成2mol SO3(s)的反应热为△H1,则△H1>-197kJ?mol-1 |
| C、甲、乙、丙3个容器中反应的平衡常数不相等 |
| D、达到平衡时,丙容器中SO2的体积分数最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可逆反应在一定条件下有一定的限度,当反应进行到一定限度后,反应物不再转化为生成物 |
| B、决定化学反应速率的主要因素是参加反应的物质的性质 |
| C、化学反应的速率和限度均可通过改变化学反应条件而改变 |
| D、化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com