
【题目】硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。

(3)步骤③中选用足量的H2O2,理由是_______________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
【答案】碱煮水洗 加快反应速率 水浴加热 C 将Fe2+全部氧化为Fe3+,不引入杂质 防止Fe3+水解 NH4Fe(SO4)2·12H2O
【解析】
(1)利用油脂能在碱性条件下水解分析。
(2)根据影响速率的因素分析。根据水浴加热能控制一定的温度范围分析。根据产生的气体成分和防止倒吸进行分析。
(3)根据过氧化氢的反应产物分析。铁离子能发生水解,要抑制其水解。
(4)根据失去的水的比重分析计算晶体中水分子个数。
(1)油污的主要成分为油脂,在碱性条件下能水解,所以可以用碱煮水洗的方法除去;
(2)温度升高可以加快反应速率;温度保持80~95 ℃适合用水浴加热的方法;铁屑中的硫化物和硫酸反应生成硫化氢气体,有毒,应选用氢氧化钠除去,为了防止倒吸,故选C;
(3) 过氧化氢能将Fe2+全部氧化为Fe3+,且不引入杂质;铁离子能水解,所以要控制溶液的pH小于0.5。
(4)设硫酸铁铵的化学式为NH4Fe(SO4)2·xH2O,其相对分子质量为266+18x,失去1.5个水分子的式量为1.5×18=27,失重5.6%,则27/(266+18x)=5.6%,解x=12,所以硫酸铁铵化学式为 NH4Fe(SO4)2·12H2O。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】砷和镍均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。与砷同周期的主族元素的基态原子中,第一电离能最大的为_____________(填元素符号。)
(2)Na3AsO3可用于碘的微量分析。
①Na+的焰色反应呈黄色,金属元素能产生焰色反应的微观原因为__________________________。
②Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3) 可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含
可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含![]() 键和π键的数目之比为___________。
键和π键的数目之比为___________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)某砷镍合金的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=___________g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计了如图所示实验,以确认某混合气体中含有 CH2=CH2 和SO2。
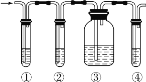
实验中提供的试剂有:A.品红溶液B.NaOH 溶液C.浓硫酸D.酸性 KMnO4 溶液试回答下列问题:
(1)写出图中①②③④ 装置盛放试剂的顺序为( 将上述有关试剂的序号填入空格内) ___________→___________→___________→___________。
(2)能说明混合气体中存在SO2 的现象是___________。
(3)能确定混合气体中存在乙烯的现象是___________。
(4)乙烯与溴水反应的化学方程式为_______,该反应的反应类型为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA是强酸
B. 该混合液pH=7
C. 图中x表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一块非常独特的手表,用 H~Mg 12 种元素分别表示 1:00~12:00,关于此表的下列说法中不正确的是( )
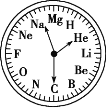
A.2:00 时的时针和 12:00 时的分针所指元素极难形成化合物
B.7:00 时,时针和分针所指元素可能形成相对分子质量为 100 的化合物
C.8:00 时,时针和分针所指元素形成的化合物属于碱性氧化物
D.3:00 时,时针所指元素的金属性比 11:00 时时针所指元素的金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.4 mol某气体的体积为9.8 L,则该气体的摩尔体积为____________。
(2)有标准状况下的四种气体:①6.72 L CH4,②3.01×1023个H2分子,③3.4 g H2S,④0.2 mol NH3,则其体积按从大到小的顺序为:_________________(填序号)。
(3)标准状况下,测得1.92克某气体的体积为672 mL,则此气体的相对分子质量为__________
(4)实验室用Na2CO3·10H2O晶体配制0.5mol/L的Na2CO3溶液970mL,应称取Na2CO3·10H2O的质量是___________。
(5)某学生欲用12mol·L-1浓盐酸和蒸馏水配制500 mL 0.3 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。
②下列实验操作会导致所配制的稀盐酸的物质的量浓度偏小的是__________(填序号)。
a.用量筒量取浓盐酸时俯视观察凹液面
b.将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中
c.稀释浓盐酸时,未冷却到室温即转移到容量瓶中
d. 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
e.容量瓶洗涤干净后未干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用以下各装置连接成一整套装置,探究氯气与氨气之间的反应。其中D 为纯净干燥的氯气与纯净干燥氨气反应的装置。

请回答下列问题:
(1)连接好装置后,必需进行的一步实验操作是_____
(2)装置E 的作用是_____,橡胶管 k 的作用是_____
(3)装置F 中试管内发生反应的化学方程式 _____
(4)装置D 内出现浓厚的白烟并在容器内壁凝结,另一产物是空气的主要成分之一,写出该反应的化学方程式_____
(5)接入D 装置的两根导管左边较长、右边较短,目的是_____
(6)整套装置从左向右的连接顺序是(j)接______、______接(f) (g)接______ 、______接______ 、______接(a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某弱酸溶液中存在电离平衡HA![]() H++A-,下列叙述不正确的是:
H++A-,下列叙述不正确的是:
A. 溶液中离子浓度的关系满足:c(H+) = c(OH-)+c(A-)
B. 常温下,加入NaA固体可使HA的电离常数增大
C. HA溶液中加少量的NaA固体,平衡逆向移动
D. 0.10mol/L的HA溶液中加水稀释,溶液中c(OH-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析能得出的结论是( )
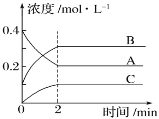
A.发生的反应可表示为2B(g)+C(g) ![]() 2A(g)
2A(g)
B.开始时,正、逆反应同时开始
C.前2 min A的分解速率为0.1mol·L-1·min-1
D.2 min时,A、B、C的浓度之比为2∶3∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com