
下列叙述中,错误的是 ( )
A.只含非极性键的纯净物一定是单质
B.只含极性键的纯净物一定是化合物
C.只含离子键的纯净物一定存在金属元素
D.纯净物中一定存在化学键
科目:高中化学 来源: 题型:
向NaBr和KI混合溶液中通入足量Cl2后,将溶液蒸干并灼烧,最后得到的物质是( )
A.NaBr和KI B.NaBr和KCl
C.NaCl和KCl D.NaCl、KCl和I2
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
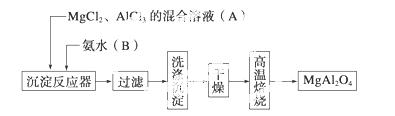
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
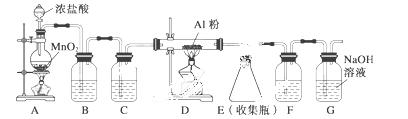
装置B中盛放饱和NaCl溶液,该装置的主要作用是______________。F中试剂的作用是________________。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是( )
A.CuS的溶解度大于PbS的溶解度
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是Cu2++S2-===CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
根据不同的研究目的,可以编制成不同的元素周期
表。将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”元素周期表,图中每个“.”代表
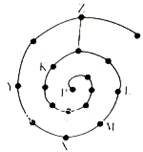 一种元素,其中P点代表氢元素(图中的字母不表示元素符号)。下列说法正确的是 ( )
一种元素,其中P点代表氢元素(图中的字母不表示元素符号)。下列说法正确的是 ( )
A.Y点元素对应的氢化物比z点元素对应的氢化物更稳定
B.虚线相连的两个点元索处于同一族
C.比Y点原子序数小8的元素,它的最高氧化物对应的水化物是一种弱酸
D.K、L、X三种元素的离子半径大小顺序是X3+>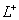 >K2-
>K2-
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)钠镁铝三种元素中第一电离能最大的是 。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
A. NH4Cl晶体 B. Na3AlF6晶体 C. Na2CO3•10H2O晶体
D. CuSO4溶液 E. CH3COOH溶液
(4)部分共价键键能数据如下表:
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 159 | 418 | 945 |
根据上表数据推算并写出由氮气和氢气合成氨气的热化学方程式: 。
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4 °C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
乙醇和二甲醚沸点及水溶性差异的主要原因是 。
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)下图是石墨的结构,其晶体中存在的作用力有 (填序号)
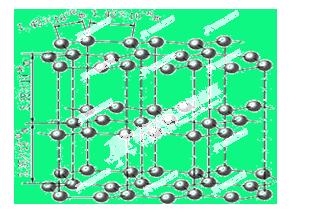
A.σ键 B.π键 C.氢键 D.配位键 E.分子间作用力 F.金属键 G.离子键
(2)下面关于晶体的说法不正确的是___________
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF> NaCl> NaBr>NaI
(3)CaF2结构如图Ⅰ所示,Cu形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3晶体结构图(层状结构,层内的H3BO3分子通过氢键结合)
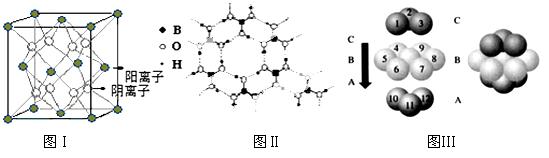
①图I所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数为 ,
图III中未标号的Cu原子形成晶体后周围最紧邻的Cu原子数为 ;
② H3BO3晶体中B原子杂化方式______ ; CNO-的形状为____________;
③三种晶体中熔点高低的顺序为 (填空化学式),
H3BO3晶体受热熔化时,克服的微粒之间的相互作用为
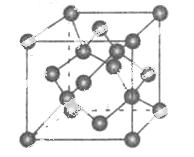
(4)碳的某种单质的晶胞如右图所示,一个晶胞中有_____个碳原子;若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个碳原子之间的距离为_ ____cm(用代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
某物质具有以下性质:①是电解质 ②溶于水有化学键被破坏 ③熔化时没有化学键被破坏,则该物质固态时属于( )
A.原子晶体 B.离子晶体
C.分子晶体 D.何种晶体无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com