
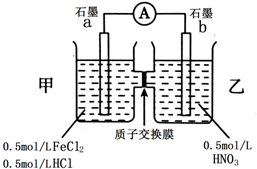
分析 (1)亚铁离子与稀硝酸反应生成NO、铁离子和水;
(2)原电池中电子从负极流向正极;
(3)乙烧杯中硝酸根离子得电子生成NO,NO遇到空气生成二氧化氮;
(4)原电池中,溶液中阳离子向正极移动,根据电荷守恒计算;
(5)正极产物为有毒气体;
(6)乙烧杯的稀硝酸换成浓硝酸,负极上仍然是亚铁离子失电子生成铁离子.
解答 解:(1)亚铁离子与稀硝酸反应生成NO、铁离子和水,则FeCl2与稀硝酸反应的离子方程式为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(2)亚铁离子在负极上失电子,则a为负极,b为正极,原电池中电子从负极流向正极,即电子从a极流向b极;
故答案为:a;b;
(3)b为正极,正极上硝酸根离子得电子生成NO,则正极反应式为:4H++NO3-+3e-=NO↑+2H2O;乙烧杯中硝酸根离子得电子生成NO,NO遇到空气生成二氧化氮,所以生成的无色气体会变为红棕色;
故答案为:生成无色气体,遇到空气变红棕色;4H++NO3-+3e-=NO↑+2H2O;
(4)原电池中,溶液中阳离子向正极移动,则H+流向乙烧杯,若一段时间内流向该烧杯的H+有0.05mol,则外电路中转移电子为0.05mol,负极电极反应为:Fe2+-e-=Fe3+,则消耗Fe2+为0.05mol,其质量为0.05mol×56g/mol=2.8g;
故答案为:乙;2.8;
(5)正极反应式为:4H++NO3-+3e-=NO↑+2H2O,正极产物NO为有毒气体,会污染空气;
故答案为:正极生成的NO会污染空气;
(6)乙烧杯的稀硝酸换成浓硝酸,负极上仍然是亚铁离子失电子生成铁离子,则a极上反应式为:Fe2+-e-=Fe3+;
故答案为:Fe2+-e-=Fe3+.
点评 本题考查了离子反应、原电池原理的应用、元素化合物的性质,题目难度中等,注意把握原电池中正负极的判断以及电极方程式的书写,侧重于考查学生对基础知识的综合应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
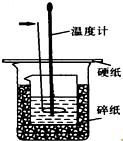 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. ;
;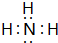 ,G的结构式为
,G的结构式为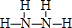 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应不需要加热即可进行反应 | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 反应物的总键能高于生成物的总键能 | |
| D. | 理论上可以使该反应的化学能直接转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅(1)(2) | B. | (1)(2)(3) | C. | (1)(2)(3)(4) | D. | 以上都不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
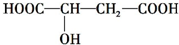
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠的电离方程式:Na2SO4=Na2++SO42- | |
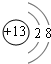
| B. | Mg2+的结构示意图: | |
| C. | 氮气的结构式::N≡N: | |
| D. | 氯化镁的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ②③⑥ | D. | ②⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com