

A.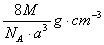 | B. 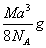  | C.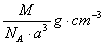 | D.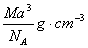 |
科目:高中化学 来源:不详 题型:单选题
| A.NaCl晶体和晶体NaF的晶格能 |
B.等物质的量的CO2分子和分子CH2=CH2中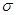 键的数目 键的数目 |
| C.等物质的量的SO2和O2在一定条件下反应,SO2与O2的转化率 |
| D.25℃时pH=11的NaOH溶液和pH=11的Na2CO3溶液中的H+的浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通常状况下,60 g SiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数) |
| B.60 g SiO2晶体中,含有2NA个Si—O键 |
| C.晶体中与同一硅原子相连的4个氧原子处于同一四面体的4个顶点 |
| D.SiO2晶体中含有1个硅原子,2个氧原子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
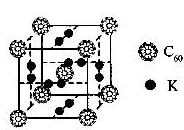
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该物质有很高的熔点、很大的硬度 | B.该物质形成的晶体属分子晶体 |
| C.该物质分子中Si60被包裹在C60里面 | D.C60易溶于水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.1∶8 | B.1∶4 | C.1∶2 | D.1∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
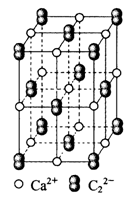
| A.1个Ca2+周围距离最近且等距离的C22-数目为6 |
| B.该晶体中的阴离子与F2是等电子体 |
| C.6.4克CaC2晶体中含阴离子0.1mol |
| D.与每个Ca2+距离相等且最近的Ca2+共有12个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com