
|
下列说法正确的是 | |
| [ ] | |
A. |
1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol·L-1 |
B. |
从1 L 2 mol·L-1的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol·L-1 |
C. |
配制500 mL 0.5 mol·L-1的CuSO4溶液,需62.5 g胆矾 |
D. |
中和100 mL 1 mol·L-1的H2SO4溶液,需NaOH 4 g |
|
A项,58.5 g NaCl的物质的量为1 mol,但溶液的体积不是1 L,故无法计算其物质的量浓度.B项取出0.5 L溶液,溶质减少一半,但它的浓度并未发生变化,仍为2 mol·L-1.C项因为500 mL 0.5 mol·L-1的CuSO4溶液中,n(CuSO4)=0.5 L×0.5 mol·L-1=0.25 mol,所以胆矾的物质的量亦为0.25 mol,即质量为0.25 mol×250 g·mol-1=62.5 g.D项因为H2SO4的物质的量为0.1 L×1 mol·L-1=0.1 mol,中和0.1 mol H2SO4需NaOH应为0.2 mol,即0.2 mol×40 g·mol-1=8 g. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
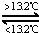 Sn(s,白)△H3=+2.1kJ?mol-1,
Sn(s,白)△H3=+2.1kJ?mol-1,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com