
【题目】二硫化钼(MoS2) 被誉为“固体润滑剂之王”,利用低品质的辉钼矿( 含MoS2、SiO2以及CuFeS2等杂质) 制备高纯二硫化钼的一种生产工艺如下:
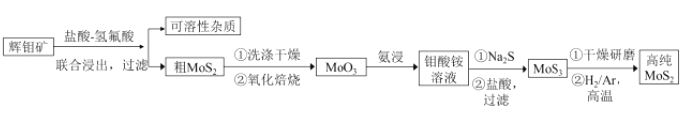
回答下列问题:
(1)钼酸铵的化学式为(NH4)2MoO4,其中Mo的化合价为________.
(2)利用联合浸出除杂时,氢氟酸可除去的杂质化学式为________如改用FeCl3溶液氧化浸出,CuFeS2杂质的浸出效果更好,写出氧化浸出时发生的化学反应方程式________。
(3)加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)MoS4],写出(NH4)2MoS4与盐酸生成MoS3沉淀的离子反应方程式____________。
(4)由下图分析产生三硫化钼沉淀的流程中应选择的最优温度和时间是___________。
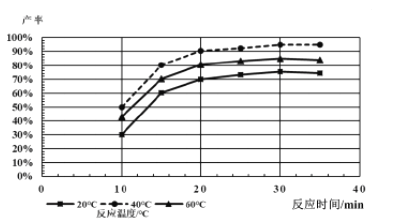
利用化学平衡原理分析低于或高于最优温度时,MoS3的产率均下降的原因:__________。
(5)高纯MoS2中3然会存在极微量杂质,如非整比晶体MoS2.8,则该杂质中Mo4+与Mo6+的物质的量之比为________________。
(6)已知Ksp(BaSO4) =1.1×10-10,Ksp(BaMoO4)=4.0×10-8),钼酸钠品体( NaMoO4·2H2O) 是新型的金属缓蚀剂,不纯的钼酸钠溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(溶液体积变化忽略),则当BaMoO4开始沉淀时,溶液中的c(MoO42-)/c(SO42-)___________(结果保留2位有效数字)
【答案】 +6 SiO2 4FeCl3+CuFeS2=5FeCl2+CuCl2+2S↓ MoS42-+2H+=MoS3↓+H2S↑ 40℃,30min 温度太低不利于H2S 逸出; 温度太高,盐酸挥发,溶液c(H+)下降,都不利于反应正向进行 1: 4 3.6×102
【解析】(1)铵根离子带1个单位正电,氧应该是-2价,所以MO为+6价。
(2)氢氟酸可以与二氧化硅反应得到SiF4气体,从而除去二氧化硅杂质。改用FeCl3溶液氧化浸出,CuFeS2杂质的浸出效果更好,说明应该得到Cu和Fe对应的离子,同时利用氧化性将S元素氧化为单质,根据化合价升降相等和原子个数守恒配平得到方程式为:4FeCl3+CuFeS2=5FeCl2+CuCl2+2S↓。
(3)(NH4)2MoS4在溶液中应该电离出铵根离子和MoS42-,MoS42-与盐酸的氢离子作用生成MOS3沉淀,则另外的生成物只能是H2S气体,所以离子反应方程式为:MoS42-+ 2H+ = MoS3↓ + H2S↑。
(4)由图像得到40℃的产率最高,30分钟以后产率就不再变化,所以选择40℃,30min。
(5)设在1mol的MoS2.8中Mo4+与Mo6+的物质的量分别为X和Y,则X+Y=1。根据化合价代数之和为0的原则,有:4X+6Y=2.8×2。解方程得到:X=0.2,Y=0.8。所以Mo4+与Mo6+的物质的量之比为0.2:0.8=1:4。
(6)因为Ksp(BaSO4) =1.1×10-10<KSP(BaMoO4)=4.0×10-8,所以先沉淀的是硫酸钡,则当BaMoO4开始沉淀时,硫酸钡已经沉淀了,所以溶液对于两种沉淀来说都是饱和的,其中的离子浓度都符合沉淀的KSP表达式。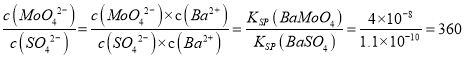


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】X元素的阳离子与Y的阴离子具有相同的核外电子排布,则下列比较中正确的是( )
A.原子序数:X<Y
B.原子半径:X<Y
C.离子半径:X>Y
D.最外层电子数:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g) ![]() 2N2+3H2O(g) ΔH<0,在恒容的密闭容器中,下列有关说法正确的是 ( )
2N2+3H2O(g) ΔH<0,在恒容的密闭容器中,下列有关说法正确的是 ( )
A. 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.氧化还原反应中可能只有一种元素的化合价发生变化
B.金属离子被还原一定得到金属单质
C.阳离子只有氧化性,阴离子只有还原性
D.在氧化还原反应中,氧化剂与还原剂不可能是同一种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)。
2NH3(g)(正反应为放热反应)。
(1)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是_____________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____________,密度_____________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,回答下列问题:
(1)已知某温度下某反应的化学平衡常数表达式为:K=![]() ,它所对应的化学反应为:__________________。
,它所对应的化学反应为:__________________。
(2)已知在一定温度下,
①C(s)+CO2(g)![]() 2CO(g) ΔH1=a kJ/mol 平衡常数K1;
2CO(g) ΔH1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g)![]() CO(g)+H2(g) ΔH3 平衡常数K3。
CO(g)+H2(g) ΔH3 平衡常数K3。
则K1、K2、K3之间的关系是________,ΔH3=__________________(用含a、b的代数式表示)。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是______反应(填“吸热”或“放热”),若在500 ℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol/L,在该条件下,CO的平衡转化率为________。
(4)高炉炼铁产生的废气中的![]() 可进行回收,使其在一定条件下和
可进行回收,使其在一定条件下和![]() 反应制备甲醇:
反应制备甲醇: ![]() 。请回答下列问题;
。请回答下列问题;
①若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
容器 | 反应物投入的量 | 反应物的转化率 |
| 能量变化( |
甲 | 1 |
|
| 放出 |
乙 | 1 |
|
| 放出 |
丙 | 2 |
|
| 放出 |
则下列关系正确的是__________。
a. ![]() b.
b. ![]() c.
c. ![]() d.
d. ![]()
e.该反应若生成1![]()
![]() ,则放出(
,则放出(![]() 热量
热量
②若在一体积可变的密闭容器中充入1![]()
![]() 、2
、2![]()
![]() 和1
和1![]()
![]() ,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________(填“正”或“逆”)反应方向移动。
,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________(填“正”或“逆”)反应方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。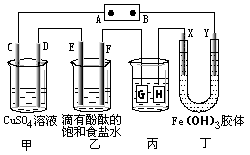
请回答:
(1)A极是电源的 , 一段时间后,甲中溶液颜色。丁中X极附件的颜色逐渐变浅,Y极附件的颜色逐渐变深,这说明。在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为。
(3)现用丙装置给铜件镀银,则G应该是 (填“镀层金属”或“镀件”),电镀液是溶液。当乙中溶液的c(OH-)=0.1mol· L-1(此时乙溶液体积为1000mL),丙中镀件上析出银的质量为 , 甲中溶液的c(H+)pH (填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是。
查看答案和解析>>
科目:高中化学 来源: 题型:
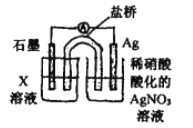
【题目】某实验小组同学在探究Fe、Fe3+、Ag+相互间的反应时,设计了如下系列实验。已知: Ag+与SCN- 生成白色沉淀AgSCN。请按要求回答下列问题。
他们先向硝酸酸化的0.05mol/L AgNO3溶液(pH≈2) 中加入稍过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色; 经检验未生成其他含氮物质.
(1)由“黑色固体”,甲猜测固体中含有Ag; 他取出少量黑色固体,洗涤后放入试管中,后续操作是_______,发现有白色沉淀产生。
(2)乙取上层清液于试管中,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀。由此得出Fe与Ag+间发生的离子反应之一为___________。
(3)由“溶液呈黄色”,丙猜测溶液中有Fe3+; 而丁认为在铁粉稍过量充分反应后的溶液中不可能合有Fe3+,其理由是(用离子方程式表示):________。
丙为证实自己的猜测,取上层清液,滴加_______,溶液变红,同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
①“白色沉淀”是_________。
②丙对Fe3+产生的原因分析:
因“未生成其他含氮物质”,故认为Fe2+不是被________氧化的。随后又提出了如下假设:
假设a:可能是铁粉表面有氧化层,与H+反应生成Fe3+;
假设b:Fe2+被O2氧化,而产生Fe3+;其对应的高子反应方程式为_________
假设c:__________氧化了Fe2+,而产生Fe3+
③丙为证实假设a、b不是主要原因,又补充了对比实验: 向硝酸酸化的(pH=2)_____中加入过量铁粉,搅拌后静置,不同时间取上层清液清加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色。
④戊为证实上述假设c成立,设计了如右图所示装置:分别取此电池工作前与工作-段时间电源计指针回至“0”时左池中的溶液,同时分别滴加K3[FeCN)6]溶液,后者蓝色沉淀较少;左池再滴加X的浓溶液,指针又有偏转。则X为________溶液;该电池总反应的离子方程式为:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列行为符合实验安全要求的是( )
A.酒精灯着火时用湿抹布熄灭
B.冷凝管中的水流方向是从上口进入,下口排出
C.将鼻孔凑到集气瓶口闻气体的气味
D.发现家中天然气泄漏,立即打开抽油烟机
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com