

| A. | 铜是阳极,铜片上有气泡产生 | B. | 溶液由无色逐渐变成蓝色 | ||
| C. | 电流由锌片流向铜片 | D. | 锌片被氧化 |
科目:高中化学 来源: 题型:选择题
| A. | 已知电离常数H2SO3 K1=1.3×10-2 K2=6.3×10-8;H2CO3 K1=4.2×10-7 K2=5.6×10-11.H2SO3溶液和NaHCO3溶液反应:H2SO3+2HCO3-═SO32-+2CO2↑+2H2O | |
| B. | 控制pH为9~10,用NaClO溶液将含NaCN的废水中的CN-氧化为两种无污染的气体:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O | |
| C. | 已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色溶液.当Pb(CH3COO)2溶液中通入H2S气体时有黑色沉淀生成:Pb2++H2S═PbS↓+2H+ | |
| D. | CuSO4溶液与过量浓氨水反应:Cu2++4NH3•H2O═[Cu(NH3)4]2++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,11.2L CO和N2混合气体中含有的原子数是NA | |
| B. | 100g 98%的浓硫酸中,氧原子总数为4NA | |
| C. | 1 mol•L-1的NaClO溶液中含有ClO-的数目小于NA | |
| D. | 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8L | B. | 3.92L | C. | 5.60L | D. | 7.84L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
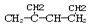 名称是1,3-二甲基-2-丁烯
名称是1,3-二甲基-2-丁烯| A. | 都不正确 | B. | ③⑤⑥正确 | C. | ②④⑥正确 | D. | ①③⑥正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
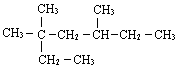 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷 2,3-二甲基1-丁烯
2,3-二甲基1-丁烯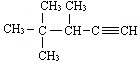 的系统名称为3,4,4-三甲基-1-戊炔
的系统名称为3,4,4-三甲基-1-戊炔 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2+Br2+H2O═H2SO4+2HBr | B. | SO2+H2O═H2SO3 | ||
| C. | SO2+2NaOH═Na2SO3+H2O | D. | SO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
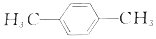 )与对苯二甲醛(
)与对苯二甲醛(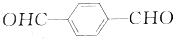 )均可被氧气直接氧化为对苯二甲酸,前后两种方案中,制备等量的对苯二甲酸时.理论上消耗的氧气物质的量之比为( )
)均可被氧气直接氧化为对苯二甲酸,前后两种方案中,制备等量的对苯二甲酸时.理论上消耗的氧气物质的量之比为( )| A. | 3:1 | B. | 2:1 | C. | 1:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com