
| A、0.5 摩1,3-丁二烯分子中含有C=C双键数为NA |
| B、1mol甲基(-CH3)所含的电子总数为9NA |
| C、标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为7/22.4NA |
| D、1 ol碳正离子(CH3+)所含的电子总数为8NA |


科目:高中化学 来源: 题型:
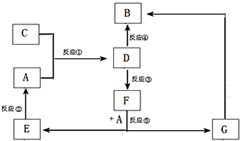 A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液.
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液.| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 |
(用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | (用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶电解质 | CaCO3 | CaSO4 |
| Ksp(mol2?L-2) | 3×10-9 | 9×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、K+、Cl-、NO3- |
| B、OH-、Cl-、Na+、NH4+ |
| C、H+、K+、Fe2+、NO3- |
| D、I-、Cl-、H+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、质子数相同的微粒一定为同一种元素 |
| B、同位素的化学性质几乎相同 |
| C、质子数相同、电子数也相同的两种微粒,不可能是一种分子和一种离子 |
| D、C12中35C1与37Cl两种核素的个数之比与HC1中35Cl与37Cl的个数之比相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌与稀硫酸反应时加入少量硫酸铜,反应加快的原因是Cu2+水解增大了H+浓度 |
| B、Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
| C、电解精炼铜时,阳极质量每减少32g,阴极析出的铜质量也为32g |
| D、用HNO2溶液做导电性实验,灯光较暗,说明HNO2是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1的Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| B、pH=2的盐酸与pH=12的氨水等体积混合:c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
| C、pH=11的Na2CO3溶液中:c(Na+)-2c(CO32-)-c(HCO3-)=10-3-10-11 |
| D、浓度分别为0.1mol?L-1和0.01mol?L-1的CH3COOH溶液中:c(CH3COO-)前者为后者的10倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
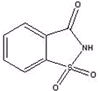 糖精是最古老的合成甜味剂,于1878年被美国科学家发现,其甜味是蔗糖的300~500倍,不被人体代谢吸收,在各种食品生产过程中都很稳定.缺点是风味差,有后苦,这使其应用受到一定限制.糖精的化学名称为邻苯甲酰磺酰亚胺,其结构简式如图所示,它的分子式为( )
糖精是最古老的合成甜味剂,于1878年被美国科学家发现,其甜味是蔗糖的300~500倍,不被人体代谢吸收,在各种食品生产过程中都很稳定.缺点是风味差,有后苦,这使其应用受到一定限制.糖精的化学名称为邻苯甲酰磺酰亚胺,其结构简式如图所示,它的分子式为( )| A、C7H8O3NS |
| B、C7H7O3NS |
| C、C7H6O3NS |
| D、C7H5O3NS |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com