
写出下列典型物质的电离方程式
(1)H2SO4_______________________________________________________________________;
(2)H2CO3_______________________________________________________________________;
(3)Ca(OH)2____________________________________________________________________;
(4)Fe(OH)3_____________________________________________________________________;
(5)NH3·H2O____________________________________________________________________;
(6)NaCl________________________________________________________________________;
(7)BaSO4______________________________________________________________________;
(8)NaHSO4_____________________________________________________________________;
(9)NaHCO3_____________________________________________________________________;
(10)NaHSO4(熔融)______________________________________________________________;
(11)Al2O3(熔融)_______________________________________________________________;
(12)CH3COOH_________________________________________________________________。
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
下图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。
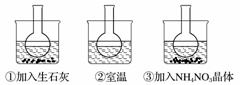
(1)含酚酞的0.01 mol·L-1 CH3COONa溶液显浅红色的原因为__________________________
(用离子方程式和必要文字解释)。
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是________(填字母)。
A.水解反应为放热反应
B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量
D.NH4NO3溶于水时吸收热量
(3)向0.01 mol·L-1 CH3COONa溶液中分别加入NaOH固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为____________、____________、____________。(填“左”、“右”或“不移动”)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时有关弱酸的电离平衡常数K1(H2Y)>K(HX)>K2(H2Y),则下列叙述不正确的是( )
A.物质的量浓度相同时,各溶液的pH关系为pH(Na2Y)>pH(NaX)>pH(NaHY)
B.a mol·L-1 HX溶液与b mol·L-1 NaOH溶液等体积混合,所得溶液中c(Na+)>c(X-),则不一定a<b
C.在HX溶液中滴入Na2Y溶液,反应2HX+Y2-===2X-+H2Y成立
D.若0.1 mol·L-1 NaHY溶液呈酸性,则其水解能力小于电离能力
查看答案和解析>>
科目:高中化学 来源: 题型:
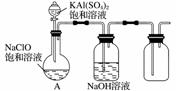
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,用离子方程式表示原因__________________________________
________________________________________________________________________。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是________________________________________________________________________。
(3)某小组同学用如图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。反应的离子方程式是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是( )
A.FeCl3溶液与Cu的反应:Cu+Fe3+===Cu2++Fe2+
B.NO2与水的反应:3NO2+H2O===2NO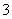 +NO+2H+
+NO+2H+
C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2:2AlO +CO2+3H2O===2Al(OH)3↓+CO
+CO2+3H2O===2Al(OH)3↓+CO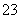
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
①将BaSO4放入水中不能导电,所以BaSO4是非电解质
②氨溶于水得到的氨水能导电,所以氨水是电解质 ③固态共价化合物不导电,熔融态的共价化合物可以导电 ④固态的离子化合物不导电,熔融态的离子化合物也不导电 ⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
A.①④ B.①④⑤
C.①②③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.由极性键构成的分子全都是极性分子
B.含有非极性键的分子一定是非极性分子
C.极性分子一定含有极性键,非极性分子一定含有非极性键
D.以极性键结合的双原子分子,一定是极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com