
| ① | ② | ③ | ④ | ⑤ | |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 | 醋酸钠 |
| pH | 11 | 11 | 3 | 3 | 8.3 |
| A、表中五种溶液.其中①~④由水电离出的c(H+):②=④>①=③ |
| B、在⑤中加入适量④至溶液呈中性,所得溶液:c(Cl-)>c(Na+) |
| C、分别将①~④加水稀释至原溶液体积的100倍后溶液的pH:①>②>③>④ |
| D、将①、④两种溶液等体积混合所得溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |


科目:高中化学 来源: 题型:
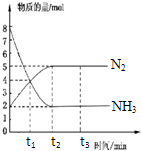 在体积一定的密闭容器中发生反应:2NH3(g)?N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示.下列叙述正确的是( )
在体积一定的密闭容器中发生反应:2NH3(g)?N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示.下列叙述正确的是( )| A、t1时反应达到平衡 |
| B、t3时,v正(N2)>v逆(N2) |
| C、t2时和t3时n(H2)相等 |
| D、t3后,若体积不变充He,反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ |
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| C、少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O═C6H5OH+HSO3- |
| D、FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、溶液中c(H+)=
| ||
B、物质的量浓度c(HA)=
| ||
C、t℃时,HA的溶解度S=
| ||
D、HA的质量分数w(HA)=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
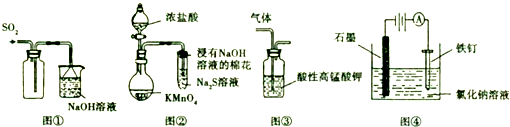
| A、可用图①所示装置收集SO2 |
| B、可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱 |
| C、可用图③所示装置除去CH4中混有的少量C2H4 |
| D、可用图④所示装置防止铁钉生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、84g NaHCO3晶体中含有NA个CO32- |
| B、0.1mol?L-1K2CO3溶液中,阴离子总数大于0.1NA |
| C、1.8g石墨和C60的混合物中,碳原子数目为0.15NA |
| D、标准状况下,22.4L CCl4中含有的共用电子对数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
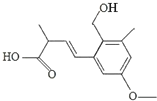 某有机物的结构简式如图,下列叙述正确的是( )
某有机物的结构简式如图,下列叙述正确的是( )| A、该有机物的分子式为C14H20O4 |
| B、该有机物能发生取代、加成和聚合反应 |
| C、1mol该有机物最多能与3mol NaOH反应 |
| D、该有机物分子中所有碳原子一定共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将少量SO2气体通入NaClO溶液中SO2+2ClO-+H2O═SO32-+2HClO |
| B、苯酚钠溶液中通入少量的二氧化碳气体C6H5O-+CO2+H2O═C6H5OH+HCO3- |
| C、足量的溴化亚铁溶液和少量的氯气反应2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| D、向氯化铝溶液中加入过量的氨水Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH皆等于3 的两种溶液都稀释100倍后,pH都为5 |
| B、10mL 0.02mol/L HCl溶液与10mL 0.02mol/L Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7 |
| C、在0.1mol/L某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A) |
| D、室温下,在一定量稀氨水中逐滴滴入稀盐酸,对于所得溶液中离子浓度大小关系可能是:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com