
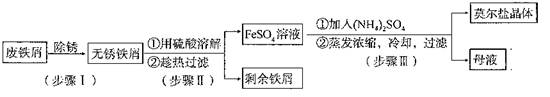
| 序号 | 实验方案 | 实验现象和结论 |
| 步骤1 | 取少量样品 | 样品颜色可能有变化。 |
| 步骤2 | 步骤1后将样品转移到试管中,加入去氧蒸馏水,振荡溶解,调节至酸性,________ ___________ __ 。 | 若 ,说明样品中含有FeSO4·7H2O杂质。 |
| 步骤3 | 若步骤2证明样品不含FeSO4?7H2O杂质,再另取样品测定其中NH4+的质量分数w1与理论值w2比较。 | 若w1 w2,说明样品中含有(NH4)2SO4杂质。 |
| 序号 | 实验方案 | 实验现象和结论 |
| 步骤1 | 取少量样品 露置空气一段时间(1分) | 样品颜色可能有变化。 |
| 步骤2 | 步骤1后将样品转移到试管中,加入去氧蒸馏水,振荡溶解,调节至酸性,_加入1~2滴KSCN溶液(2分)__ | 若溶液变成血红色(2分),说明样品中含有FeSO4·7H2O杂质。 |
| 步骤3 | 若步骤2证明样品不含FeSO4 ·7H2O杂质,再另取样品测定其中NH4+的质量分数w1与理论值w2比较。 | 若w1 >(或大于)(1分)w2,说明样品中含有(NH4)2SO4杂质。 |
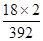 ×100%=9.18%,而(NH4)2SO4中NH4+的质量分数计算表达式为:w2=
×100%=9.18%,而(NH4)2SO4中NH4+的质量分数计算表达式为:w2=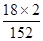 ×100%=23.68%,因此理论值w2=9.18%,若含有(NH4)2SO4时,w1介于二者9.18%与23.68%之间,所以w1> w2时,说明摩尔盐中含有硫酸铵杂质。
×100%=23.68%,因此理论值w2=9.18%,若含有(NH4)2SO4时,w1介于二者9.18%与23.68%之间,所以w1> w2时,说明摩尔盐中含有硫酸铵杂质。

 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
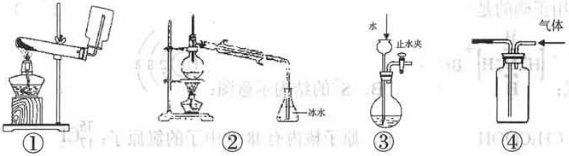
| A.①——实验室制取并收集足量NH3 |
| B.②——以溴化钾、90%硫酸、乙醇为原料合成溴乙烷的装置 |
| C.③——检查装置气密性 |
| D.④——利用排空气法收集CO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
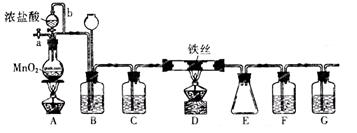
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.防止氯气扩散到空气中造成污染 | B.便于控制加入盐酸的量 |
| C.长颈漏斗不便于添加液体 | D.尽量避免HCl挥发到空气中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 |
| B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。 |
| C.用胶头滴管向容量瓶中加水时溶液凹液面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切。 |
| D.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度相切。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除去CO2中的少量CO:通入O2,点燃 |
| B.除去Na2CO3稀溶液中的少量NaHCO3:加热 |
| C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤 |
| D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com