
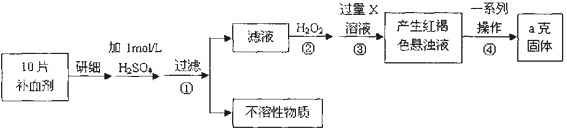
分析 由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂氯水将Fe2+氧化为Fe3+.检验Fe2+可以先滴加KSCN溶液,溶液不变色,再滴加氯水或双氧水,溶液变为血红色,说明含有Fe2+;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,同时生成水.
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,加入试剂X为氢氧化钠溶液或氨水;
(4)实际上向滤液中直接滴加X溶液最终也会生成红褐色浊液,是利用亚铁离子沉淀生成氢氧化亚铁,在空气中被氧气氧化生成红褐色沉淀氢氧化铁,此过程中发生的氧化还原反应为氢氧化亚铁被氧化为氢氧化铁;
(5)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(6)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算.
(7)根据铁元素守恒可知16.8mg铁即为FeSO4•7H2O片剂中铁的质量,根据化学式中铁元素质量分数的计算来求算FeSO4•7H2O的片剂的质量.
解答 解:(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂氯水将Fe2+氧化为Fe3+,检验Fe2+可以先滴加KSCN溶液,溶液不变色,再滴加氯水或双氧水,溶液变为血红色,说明含有Fe2+,
故答案为:先滴加KSCN溶液,再滴加新制氯水或双氧水;先无明显变化,滴加新制氯水或双氧水后溶液变为血红色;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,同时生成水,反应离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,加入X为氢氧化钠溶液或氨水,反应离子方程式为:Fe3++3OH-═Fe(OH)3↓或Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,
故答案为:Fe3++3OH-═Fe(OH)3↓或Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+;
(4)实际上向滤液中直接滴加X溶液最终也会生成红褐色浊液,是利用亚铁离子沉淀生成氢氧化亚铁,在空气中被氧气氧化生成红褐色沉淀氢氧化铁,此过程中发生的氧化还原反应为氢氧化亚铁被氧化为氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(5)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:过滤;灼烧;
(6)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量$\frac{ag×\frac{112}{160}}{10}$=0.07ag,
故答案为:0.07a;
(7)14mg铁即为FeSO4•7H2O片剂中铁的质量,所以需要FeSO4•7H2O片剂质量为($\frac{14}{56}$×278)mg=69.5mg,
故答案为:69.5.
点评 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、氧化还原滴定应用、化学计算等,题目难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:多选题
| A. | 有机物均易燃烧 | |
| B. | 苯酚酸性比碳酸弱,故苯酚不能与碳酸钠溶液反应 | |
| C. | 制取乙酸乙酯时,试剂的混合顺序是先加浓硫酸,再加乙醇,然后加乙酸 | |
| D. | 石油分馏得到的汽油是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硒(Se)化氢比硫化氢稳定 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 铍(Be)的原子失电子能力比镁弱 | |
| D. | 氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定序号[来源:学科网] | 待测液体积(mL) | 所消耗标准盐酸的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铵盐都易溶于水 | |
| B. | 铵盐受热分解都能得到氨气 | |
| C. | 除去NH4Cl溶液中少量的CaCl2,加过量的NH4HCO3溶液后过滤 | |
| D. | 铵盐与碱液共热都能生成使蓝色石蕊试变红的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,正极电极反应是 Pb(s)+SO42-(aq)═PbSO4(s)+2e- | |
| B. | 放电时,电池的负极材料是铅板,负极质量增加 | |
| C. | 充电时,电池中硫酸的浓度始终保持不变 | |
| D. | 充电时,阳极发生的反应是 PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
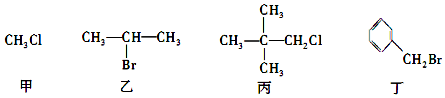
| A. | 甲、乙、丙、丁中加入NaOH的醇溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,均有沉淀生成 | |
| B. | 甲中加入NaOH的水溶液共热,再滴入AgNO3溶液,可检验该物质中含有的卤素原子 | |
| C. | 乙发生消去反应得到两种烯烃 | |
| D. | 丙与NaOH的水溶液共热,反应后生成的醇能被氧化为醛 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com