
| A. | 0.25 mol H2SO4 | B. | 1 mol H2O | C. | 40 g CaO | D. | 80 g Fe2O3 |
分析 16g O2中O原子的物质的量为$\frac{16g}{32g/mol}$×2=1mol,O原子的物质的量相同时其数目相同,据此分析.
解答 解:16g O2中O原子的物质的量为$\frac{16g}{32g/mol}$×2=1mol,
A.0.25 mol H2SO4中O原子的物质的量为1mol;
B.1 mol H2O中O原子的物质的量为1mol;
C.40 g CaO中O原子的物质的量为$\frac{40g}{56g/mol}$=$\frac{5}{7}$mol;
D.80 g Fe2O3中O原子的物质的量为$\frac{80g}{160g/mol}$×3=1.5mol;
所以与16g O2中含有的氧原子数不相同的是CD;
故选CD.
点评 本题考查常用化学计量的有关计算,比较基础,注意对公式的理解与灵活运用,注意理解分子中微粒数目的计算.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | KMnO4溶液、FeCl3溶液 | B. | 溴水、KMnO4溶液 | ||
| C. | NaOH溶液、FeCl3溶液 | D. | 溴水、Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA是弱酸 | B. | HA的电离方程式为HA═H++A- | ||
| C. | 该溶液中c(HA)+c(A-)=0.1 mol•L-l | D. | NaA溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有强氧化性,但SO2气体可以用浓硫酸干燥 | |
| B. | 常温下实验室可以用稀硝酸与铁反应制取NO气体 | |
| C. | 王水溶解金的过程为氧化还原反应,还原产物为NO2 | |
| D. | SiO2不仅能与氢氧化钠溶液反应,也能与氢氟酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{H}_{4}^{+})}$ | B. | $\frac{c(N{H}_{4}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | ||
| C. | $\frac{c{H}^{+}}{cO{H}^{-}}$ | D. | c(H+)•c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大 | |
| B. | 甲烧杯中的酸过量 | |
| C. | 两烧杯中参加反应的锌等量 | |
| D. | 反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
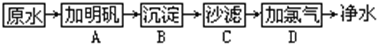
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液中:Na+、AlO2-、SO42-、NO3- | |
| B. | b点对应的溶液中:Ba2+、K+、NO3-、Cl- | |
| C. | c点对应的溶液中:Na+、Ag+、Mg2+、NO3- | |
| D. | d点对应的溶液中:Cl-、NO3-、Fe2+、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com