
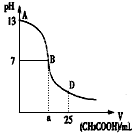
I.下图为向25mL0.1mol/L NaOH溶液中逐滴滴加0.2moL/L CH3COOH溶液过程中溶液pH的变化曲线
 |
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确? (选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间内还是BD区间内? (若正确,此问不答)
(2)关于该滴定实验,从下列选项中选出最恰当的一项


(3)在AB区间内,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)的大小关系是
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)可能大于、小于或等于C(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH) 2c(Na+)。(填“>”、“<”或“=”)
Ⅱ.在温度t℃时,某NaOH稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
(5)该温度下水的离子积常数Kw=
(6)该NaOH稀溶液中NaOH物质的量浓度的精确值是 mol/L(用含字母的表达式表示)
(7)在该温度下(t℃),将100mL 0.1mol/L的稀H2SO4溶液与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=
(1) 否,AB⑵C⑶D⑷=⑸Kw=10![]() (6) 10
(6) 10![]() -10
-10![]() (7) 11
(7) 11
此题考查了酸碱中和滴定、水的离子积常数、水解、电离平衡的知识。
问题⑴:,NaOH与CH3COOH反应生成的CH3COONa是强碱弱酸盐,在水中水解使溶液碱性,即NaOH与CH3COOH恰好反应时溶液应显碱性,由图象可知,在B点时pH=7,表明溶液中c(H+)=c(OH—),因此二者恰好反应的点应该在AB区间,题中的说法是错误的。
问题⑵:从图象中pH的变化可知是用CH3COOH滴定NaOH溶液,则锥形瓶中盛放的是碱,滴定管中装的是酸,应该选用酸式滴定管,且二者恰好反应是溶液显碱性,酚酞的变色范围是pH在8.0—10,选用酚酞产生的误差较小,结合选项应该选C。
问题⑶:此实验是用CH3COOH滴定NaOH溶液,开始时醋酸根很少,c(OH—)﹥c(CH3COO—),随着反应的进行c(OH—)逐渐减小,c(CH3COO—)逐渐增大,在溶液呈中性之前,会出现c(OH—)=c(CH3COO—)、c(OH—)﹤c(CH3COO—)。应该选D。
问题⑷:根据物料守恒:溶液中的CH3COOH和CH3COO—都是由加入的醋酸提供的,据此可以计算出在D点时二者的浓度之和为:c(CH3COO—)+c(CH3COOH)=0.2mol/L×0.025L÷0.050L=0.1mol/L。此时溶液中c(Na+)=0.1mol/L×0.025L÷0.050L=0.05mol/L,即:c(CH3COO—)+c(CH3COOH)=2c(Na+)。
问题⑸水的离子积常数Kw=c(H+)c(OH—),结合题给二者浓度数据可得
Kw=c(H+)c(OH—)=10![]() ×10
×10![]() =10
=10![]() =10
=10![]() 。
。
问题(6):在此溶液中存在H2O![]() H+ + OH—、NaOH
H+ + OH—、NaOH![]() Na+ + OH—,OH—由水和氢氧化钠共同提供,H+只由水提供,且水提供的H+与OH—的浓度相等,所以此溶液中NaOH物质的量浓度的精确值为10
Na+ + OH—,OH—由水和氢氧化钠共同提供,H+只由水提供,且水提供的H+与OH—的浓度相等,所以此溶液中NaOH物质的量浓度的精确值为10![]() -10
-10![]() 。
。
问题⑺:由题意简单计算可知在此反应中碱过量,反应后溶液中OH—的浓度是:
C(OH—)=(0.4mol/L×0.1L-2×0.1mol/L)÷0.2L=0.1mol/L,
c(H+)=Kw÷C(OH—)=10![]() ÷0.1mol/L=10
÷0.1mol/L=10![]() mol/L,则pH=11。
mol/L,则pH=11。
选做部分
说明:共2个小题,任选一题作答。两题均做按第一题给分。


 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:阅读理解
I.某中和滴定实验过程如下:
(1)取一支用蒸馏水洗净的酸式滴定管,加入标准的盐酸溶液,记录初始读数
(2)用碱式滴定管放出一定量待测液,置于未用待测液润洗的锥形瓶中,加入酚酞2滴
(3)滴定时,边滴加边振荡,同时注视滴定管内液面的变化
(4)当滴到溶液由红色变为无色,颜色稳定后停止滴定,记录液面读数
请选出上述实验过程中的错误之处 (填序号)。
II.某烧碱溶液中含有少量杂质(不与盐酸反应),现用盐酸溶液测定其浓度。
(1)滴定:下图表示某次滴定时50 mL酸式滴定管中前后液面的位置,请将相关数据填入下表空格中。
| 滴定序号 | 待测液体积 (mL) | 所消耗盐酸体积(mL)(滴定前) | 所消耗盐酸体积(mL)(滴定后) | 所消耗盐酸体积(mL) |
| 1 | 25.00 | 0.50 | 25.12 | 24.62 |
| 2 | 25.00 |
|
|
|
| 3 | 25.00 | 6.00 | 30.58 | 24.58 |
(2)盐酸浓度为0.1000mol/L。根据所给数据,计算样品中烧碱的物质的量浓度c = 。
(3)下列几种情况所测烧碱浓度与实际浓度相比:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则测定结果 ;
b.酸式滴定管读数时,若滴定前仰视,滴定后俯视,则测定结果 ;
c.酸式滴定管中滴定前有气泡,滴定后气泡消失,则测定结果 ;
III.向25mL 0.1mol/L NaOH 溶液中加入25mL 0.2mol/L CH3COOH溶液,充分反应后
(pH<7),溶液中下列微粒:Na+,OH-,CH3COO-,H+,CH3COOH的浓度由大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源:名师原创题大全 题型:推断题
现有E、F、H、I、G、K六种原子序数依次增大的前四周期主族元素,且分属四个不同周期,E、G同主族,F、H、I为同周期相邻的三种元素,其中F元素形成的化合物种类是所有元素中最多的,I、G简单离子具有相同的电子层结构,K与F形成的离子化合物Q与E和I形成的常见共价化合物R之间的反应是实验室常见的可燃气体制备原理。(题中的字母只代表元素代号,与实际元素符号无关),请回答下列问题:
(1)E~K六种元素原子,原子半径第三大的是 (填对应的元素符号,下同)。
(2)E与H两种元素组成一种阳离子,该离子的结构式为 。
(3)I、G两种元素组成含有两种化学键的化合物,该化合物的电子式为
。
(4)下图为常温下向25mL 0.1 mol·L-1由E、I、G组成的化合物W溶液中逐滴滴加0.2 mol·L-1E、F、I组成相对分子质量为60的一元酸Z溶液过程中溶液pH的变化曲线。 
①上图能确定Z为 (“强”或“弱”)酸,理由是
②B点溶液呈中性,有人据此认为,在B点时W与Z恰好完全反应,这种看法是否正确? (选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内? 区间(若正确,此问不答)。
(5)写出Q与R之间的化学反应方程式 。
查看答案和解析>>
科目:高中化学 来源:2011届黑龙江省哈三中高三12月月考(理综)化学部分 题型:实验题
I.某中和滴定实验过程如下:
(1)取一支用蒸馏水洗净的酸式滴定管,加入标准的盐酸溶液,记录初始读数
(2)用碱式滴定管放出一定量待测液,置于未用待测液润洗的锥形瓶中,加入酚酞2滴
(3)滴定时,边滴加边振荡,同时注视滴定管内液面的变化
(4)当滴到溶液由红色变为无色,颜色稳定后停止滴定,记录液面读数
请选出上述实验过程中的错误之处 (填序号)。
II.某烧碱溶液中含有少量杂质(不与盐酸反应),现用盐酸溶液测定其浓度。
(1)滴定:下图表示某次滴定时50 mL酸式滴定管中前后液面的位置,请将相关数据填入下表空格中。
| 滴定序号 | 待测液体积 (mL) | 所消耗盐酸体积(mL)(滴定前) | 所消耗盐酸体积(mL)(滴定后) | 所消耗盐酸体积(mL) |
| 1 | 25.00 | 0.50 | 25.12 | 24.62 |
| 2 | 25.00 | | | |
| 3 | 25.00 | 6.00 | 30.58 | 24.58 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年黑龙江省高三12月月考(理综)化学部分 题型:实验题
I.某中和滴定实验过程如下:
(1)取一支用蒸馏水洗净的酸式滴定管,加入标准的盐酸溶液,记录初始读数
(2)用碱式滴定管放出一定量待测液,置于未用待测液润洗的锥形瓶中,加入酚酞2滴
(3)滴定时,边滴加边振荡,同时注视滴定管内液面的变化
(4)当滴到溶液由红色变为无色,颜色稳定后停止滴定,记录液面读数
请选出上述实验过程中的错误之处 (填序号)。
II.某烧碱溶液中含有少量杂质(不与盐酸反应),现用盐酸溶液测定其浓度。
(1)滴定:下图表示某次滴定时50 mL酸式滴定管中前后液面的位置,请将相关数据填入下表空格中。

|
滴定序号 |
待测液体积 (mL) |
所消耗盐酸体积(mL)(滴定前) |
所消耗盐酸体积(mL)(滴定后) |
所消耗盐酸体积(mL) |
|
1 |
25.00 |
0.50 |
25.12 |
24.62 |
|
2 |
25.00 |
|
|
|
|
3 |
25.00 |
6.00 |
30.58 |
24.58 |
(2)盐酸浓度为0.1000mol/L。根据所给数据,计算样品中烧碱的物质的量浓度c = 。
(3)下列几种情况所测烧碱浓度与实际浓度相比:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则测定结果 ;
b.酸式滴定管读数时,若滴定前仰视,滴定后俯视,则测定结果 ;
c.酸式滴定管中滴定前有气泡,滴定后气泡消失,则测定结果 ;
III.向25mL 0.1mol/L NaOH 溶液中加入25mL 0.2mol/L CH3COOH溶液,充分反应后
(pH<7),溶液中下列微粒:Na+,OH-,CH3COO-,H+,CH3COOH的浓度由大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源:0119 竞赛题 题型:填空题
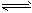 CH3COO-+H+。
CH3COO-+H+。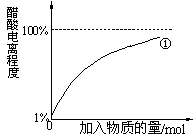

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com